泰格洞见
肿瘤治疗领域的『希望新星』:抗体偶联药物(ADC)
2022年08月04日
根据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球最新癌症负担数据,2020年,全球新发癌症病例1929万例,癌症死亡病例996万例,位列前10的癌症分别为乳腺癌、肺癌、结直肠癌、前列腺癌、胃癌、肝癌、宫颈癌、食管癌、甲状腺癌、膀胱癌。从发病率来看,其发病例数已经占据全部新发癌症60%以上;从死亡率来看, 其死亡病例数占据全部癌症死亡病例70%以上[1]。
为了攻克这一医学难题,全球学者、各大药企都在积极研发有效治疗方案,CAR-T细胞免疫疗法、PD-1免疫疗法等等相继成为肿瘤治疗领域近年来炙手可热的明星。而今,有着“魔法子弹”之称的抗体偶联药物(Antibody-Drug Conjugate,ADC)也迎来了全面爆发。
近期,Signal Transduction and Targeted Therapy发表了一篇题为“Antibody drug conjugate: the ‘biological missile’ for targeted cancer therapy”(图1)的综述文章,对ADC药物的前世今生及其当下挑战进行了系统梳理。

图1 综述文章截图(图源:[1])
ADC药物:癌症靶向治疗的“魔法子弹”
ADC药物是通过化学键将具有生物活性的细胞毒药物连接到单克隆抗体上,单克隆抗体作为载体将细胞毒药物靶向运输到目标细胞中发挥作用的一类药物。ADC药物一方面延续了单抗药物可特异性靶向的特点,同时又规避了常规细胞毒性物质由于过量毒性不可系统性给药的缺点。
ADC的设计理念最早于20世纪初由Paul Ehrlich首次提出,2000年,美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)批准首款ADC药物Mylotarg®(gemtuzumab ozogamicin)用于治疗成人急性髓系白血病,标志着癌症靶向治疗ADC时代的开始[2]。相比于其他肿瘤治疗药物,ADC药物可以同时克服靶向治疗和传统化疗的局限性。那ADC药物是如何构成的?又是如何发挥肿瘤杀伤作用的?
被誉为“魔法子弹”的ADC药物主要由三部分构成(图2):“杀伤弹药”小分子细胞毒药物(有效载荷)、“制导系统”靶向肿瘤细胞表面特异性抗原的单克隆抗体以及将两者连接起来的连接子[2],这种结构的优势在于具备高效的靶向性和杀伤肿瘤细胞的能力。
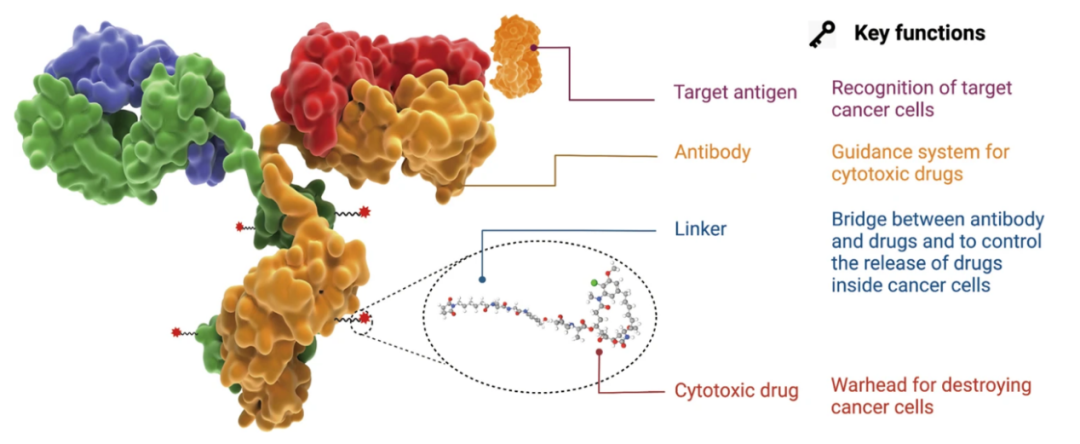
图2 ADC药物的构成(图源:[2])
就ADC药物的作用机制而言,这类药物可协同发挥“特异性”靶向作用和“高效”杀伤癌细胞的作用,能够精准杀伤癌细胞,提高治疗窗口,减少脱靶副作用。
具体而言,ADC药物进入血液,其抗体部分在与肿瘤细胞表面靶抗原结合后,ADC-抗原复合物就会被肿瘤细胞内化,形成早期内体,随后成熟为晚期内体,最后与溶酶体融合。细胞毒性药物最终通过溶酶体中的化学或酶介导释放,通过靶向DNA或微管导致细胞凋亡或死亡,这是ADC药物的核心作用机制(图3)。此外,细胞毒药物从ADC复合物上提前裂解释放进入内循环后,也可发挥作用,即稳定存在于肿瘤微环境中发挥局部抗肿瘤作用,这一作用途径被称为“旁观者效应”[3]。部分ADC还通过抗体依赖性细胞毒性、补体依赖性细胞毒性或抗体依赖性细胞吞噬作用等途径诱导肿瘤细胞的凋亡。
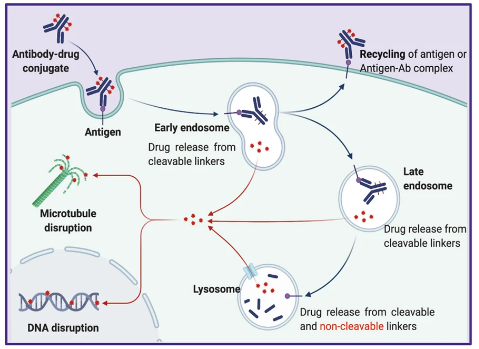
图3 ADC的核心作用机制(图源:[1])
精准抗癌:“魔法子弹”ADC药物的进阶之路
自第一个ADC药物Mylotarg®获批以来,截至2022年6月,全球已有14个ADC药物获得市场批准。此外,目前还有众多ADC药物已在临床阶段。作为新型抗癌药物,ADC正在引领癌症靶向治疗的新时代。
(一)历经三代技术变革,ADC药物抗癌活性更强
发展至今,ADC药物已经经历三代技术变革。
第一代ADC药物,Mylotarg作为第一个获批上市的ADC,标志着此类治疗药物的里程碑,此时的ADC主要由常规化疗药物通过不可切割的接头与小鼠来源的抗体偶联而成,免疫原性强且副作用大,主要采用随机偶联方式连接。
第二代ADC药物,在优化抗体同种型、细胞毒性药物以及连接子后推出,以Adectris、Kadcyla等药物为代表,抗体方面选择了人源化抗体,免疫原性大大降低。其另一个重大突破在于使用了更高效的细胞毒药物,提高了水溶性和偶联效率。此外,第二代ADC药物中的连接子也进行了改进,实现了更好的血浆稳定性和均匀的DRA分布。
第三代ADC药物,以Padcev、Enhertu为代表,选用全人源性抗体,几乎无免疫原性,且细胞毒性药效更强。此外,与前两代ADC药物相比,第三代ADC药物的偶联方式升级为定点偶联。整体上来说,第三代ADC毒性更低、抗癌活性更强、稳定性更高。
表1 ADC历经三代技术变革
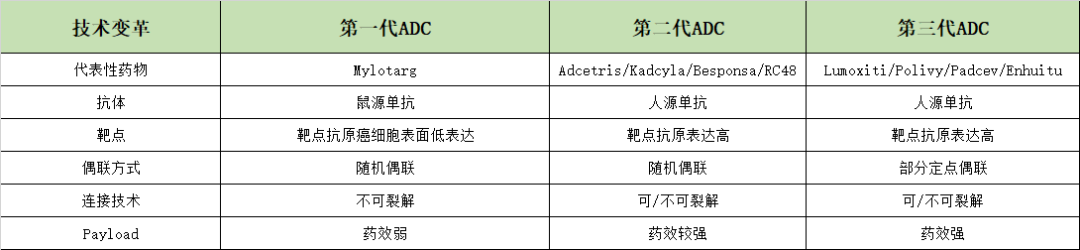
根据公开资料整理
(二)全球已获批上市的ADC药物概览
截至2022年6月,全球已经有14款ADC药物批准上市[2],主要包括Adcetris®、Kadcyla®、Besponsa®、Mylotarg®,Polivy®、Padcev®、Enhertu®、Trodvy®、Blenrep®和Zynlonta™、Lumoxiti、Akalux、爱地希®、Tivdak,7款用于血液瘤,7款用于实体瘤,这些ADC药物主要作为单药或联合用药用于乳腺癌、尿道癌、胃癌、宫颈癌、头颈部肿瘤、骨髓瘤、急性白血病和淋巴瘤的治疗。全球已上市ADC药物的整体市场规模在2021年超过50亿美元[4]。
表2 已上市ADC药物靶点分布情况
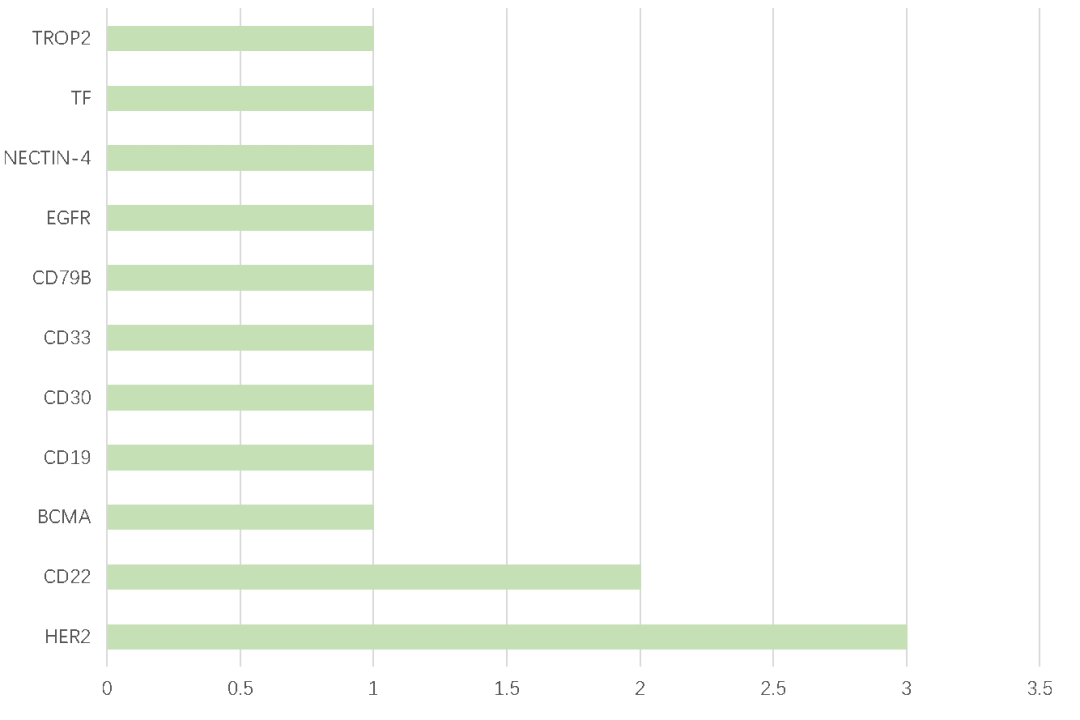
数据来源:FDA、CDE、Insight数据库
(三)ADC药物研发如火如荼,开始步入黄金时代
从全球布局ADC赛道的药企来看,由于国外企业起步较早所以在研管线众多且发展速度较快,如罗氏、吉利德、第一三共、辉瑞等等,其中行业龙头为Seagen。国内企业方面,荣昌生物、云顶新耀、乐普生物、多僖生物、科伦博泰等企业均有在ADC领域布局。
1.海外ADC药物研发产线丰富
国外药企中Seagen、第一三共等有较为丰富的在研ADC产品。
Seagen:行业首屈一指的ADC药企
在全球已上市的14款ADC药物中,Seagen参与研发4款,包括3款自主研发的ADC以及1款合作开发的ADC,是ADC行业的领导者。除了已上市的4款ADC药物,该公司还有4款正处于临床阶段的ADC。
已上市的4款ADC分别是靶向CD30的Adcetris、靶向Nectin-4的Padcev、靶向TF的Tivdak以及与荣昌生物合作开发靶向HER2的爱地希;处于临床阶段的4款ADC分别是靶向LIV-1的Ladiratuzumab vedotin、靶向CD228的SGN-CD228A、靶向SGN-B6A、靶向STn的SGN-STNV。
已上市的ADC药物上文已有提及,关于处在临床阶段的4款ADC药物中,最值得关注的是靶向LIV-1的Ladiratuzumab vedotin,因为目前只有这款处于临床阶段的药物靶向LIV-1,其抗体部分为靶向LIV-1人源化lgG1单抗SLC39A6,细胞毒药物为Seagen经典的mc-VC-MMAE[5]。在适应症方面,目前Ladiratuzumab vedotin和默沙东K药联用的关于转移性三阴乳腺癌的适应症处于临床Ⅲ期,治疗8种实体瘤处于Ⅱ期临床,关于转移性乳腺癌的临床处于Ⅰ期。
2. 多家本土药企布局ADC研发
国内目前已有多款ADC产品上市,仍以跨国药企产品为主。国内企业方面,荣昌生物的维迪西妥单抗于2021年6月获NMPA上市,成为首款上市的国产ADC药物。2022年6月,云顶新耀引进开发的Trop2 ADC疗法注射用戈沙妥珠单抗获NMPA批准上市。
荣昌生物:首个国产ADC维迪西妥单抗
荣昌生物目前有7个在研ADC产品管线,其中维迪西妥单抗(商品名爱地希,研究代号RC48)的胃癌、尿路上皮癌适应症已经上市,并正在积极拓展HER2低表达乳腺癌、胆道癌以及联合用药等应用,其他ADC管线基本还处在IND/Ⅰ期阶段(表3)。
表3 荣昌生物ADC药物产品管线
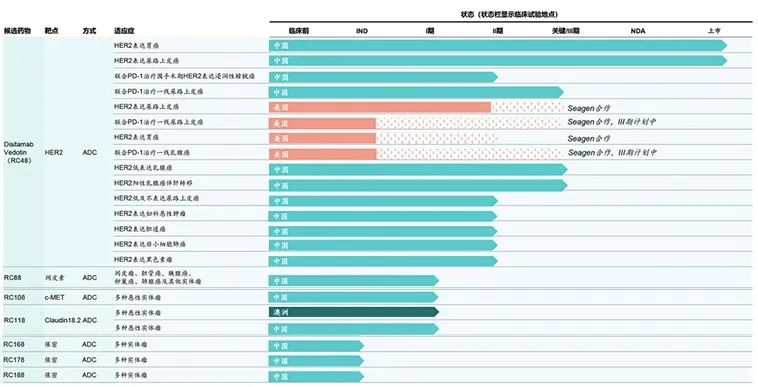
表格来源:荣昌生物官网
2021年6月,国家药监局通过优先审评审批程序,附条件批准RC48上市,用于治疗至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌患者。12月,RC48第二个适应症获批上市,用于治疗HER2过表达局部晚期或转移性尿路上皮癌,成为全球首个靶向HER2治疗尿路上皮癌的ADC药物。
除了靶向HER2的RC48之外,荣昌生物在ADC产品管线上还进行了广泛的靶点布局,且已有3款ADC管线进入临床1期,分别靶向间皮素、c-MET、CLDN18.2,以及若干未公布靶点的ADC药物正处于临床前研究阶段。
繁荣中仍有隐忧:ADC药物开发面临诸多挑战
ADC作为一种治疗方法前景向好,未来的可应用范围甚至很可能会超出肿瘤治疗领域的“药物新星”。虽然近年来,ADC药物已经获得前所未有的突破,多款药物已经开始造福肿瘤患者,但是ADC药物的进一步发展依然面临很多挑战。
(一)更为复杂的制备工艺
由于ADC是由抗体、细胞毒药物以及连接子三部分构成,这一结构的复杂性就决定了与单抗等药物相比ADC药物的制备工艺会更加复杂。在ADC药物的制备过程中,需要综合考量多种因素,比如抗体、连接子、偶联方式、细胞毒药物的选择,同时还要考虑药物抗体比、载药量分布、游离药物清除等等方面。这些因素环环相扣,任何一个环节出现问题可能都会导致ADC药物无法获得良好效果。因此,过于复杂的制备工艺是ADC药物研发过程中面临的挑战之一。
(二)ADC药物的脱靶毒性
脱靶毒性是ADC药物不良反应的主要来源,指的是未表达靶抗原的器官/细胞中出现的药物毒性[6],是现有ADC药物不良反应的主要原因。ADC药物的脱靶毒性可能与细胞毒性药物过早释放到血液循环、ADC药物被正常细胞非特异性摄取或ADC的抗体与正常细胞产生非特异性结合等因素有关[6],其中细胞毒药物的过早释放是主要原因。此外,ADC药物的抗体部分诱导的免疫反应可能引起继发性损伤,导致肾毒性。
(三)肿瘤靶向和有效载荷释放
与传统的细胞毒药物相比,ADC药物的分子量要大得多,药物穿透肿瘤的效率有限。目前的研究表明,只有一小部分输入患者体内的ADC药物可以到达肿瘤细胞,因此在设计ADC药物时需要考虑有效载荷的效力。
(四)不得不面对的耐药性
在ADC药物开发过程中,耐药性是不得不面对的问题,当治疗失败或治疗有效性下降以及肿瘤细胞逃避时,就会出现耐药性的问题,ADC结构的任何一个组成成分出现异常或在周期性压力下都会导致耐药性的产生。使ADC药物产生耐药性的机制有很多,包括抗原表达水平下降、药物外排泵、内吞和迁移障碍、溶酶体功能障碍、信号通路的改变和细胞凋亡失调等等。
表4 ADC药物的耐药机制

根据公开资料整理
上述从构成、作用机制、技术变革、在研产品以及挑战等方面对肿瘤治疗领域的『希望新星』——ADC药物进行了基本介绍,可以看出该类药物在乳腺癌、胃癌、尿路上皮癌以及血液瘤等的治疗中已经显示出良好的效果,相信随着研发人员对ADC药物认知的深入以及各项制备技术的发展,ADC药物活性会更强、副作用会更小,将会造福更多肿瘤患者。
最后,借用《我不是药神》这部影片中病友群的一句话“我们终于看到了活下去的『希望』”,相信肿瘤治疗领域的希望新星——抗体偶联药物,可以为千千万万的肿瘤患者带去生存的希望。
免责声明:本文基于相关文献及已公开资料撰写,不构成对任何人、任何机构的投资建议。
参考资料
[1] Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chin Med J (Engl). 2021 Mar 17;134(7):783-791. doi: 10.1097/CM9.0000000000001474. PMID: 33734139; PMCID: PMC8104205.
[2]Fu Z, Li S, Han S,et al. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93. doi: 10.1038/s41392-022-00947-7. PMID: 35318309; PMCID: PMC8941077.
[3]神奇的“魔法子弹” — 抗体偶联药物(ADC)。https://mp.weixin.qq.com/s/iswYA3MaEhtO8xg1aZZjNQ
[4]ASCO-2022透视全球ADC研发进展——全球创新药系列研究之会议追踪
[5] https://mp.weixin.qq.com/s/ztp8LNDWJ-VHmwOwt2Be9A
[6] Li X, Nelson CG, Nair RR, et al. Stable and Potent Selenomab-Drug Conjugates. Cell Chem Biol. 2017 Apr 20;24(4):433-442.e6. doi: 10.1016/j.chembiol.2017.02.012. Epub 2017 Mar 16. PMID: 28330604; PMCID: PMC5400723.
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。