泰格洞见
生物大分子药物IND期间药效研究考虑要点
2022年08月26日
常见的生物大分子药物主要包括多肽、蛋白质、抗体、疫苗与核酸等,其药效学研究是为了研究药物与其预期治疗靶点相关的作用机制和/或效应,阐明药物的作用特点,为设计和优化临床试验方案,揭示药物的毒性机制提供理论依据。药效学研究通常在药物开发的阶段进行,因此一般不需要遵循药物非临床研究质量管理规范(GLP)。
我们知道,与传统小分子药物不同,生物大分子药物的作用机制主要是通过刺激机体免疫系统产生免疫物质(如抗体)从而发挥其功效,在人体内出现体液免疫、细胞免疫或细胞介导免疫,因此常规用于小分子药物的药效学研究方法基本不适用于此类药物,可根据国内已发布的相关的指导原则(见表1),以“case by case” 的原则灵活设计药效学研究,综合考虑目标适应症、给药途径,给药剂量、动物模型与种属、免疫原性等对药效的影响,以充分反映药物的药效。
本文主要介绍单抗类产品在IND期间药效学研究考虑要点。
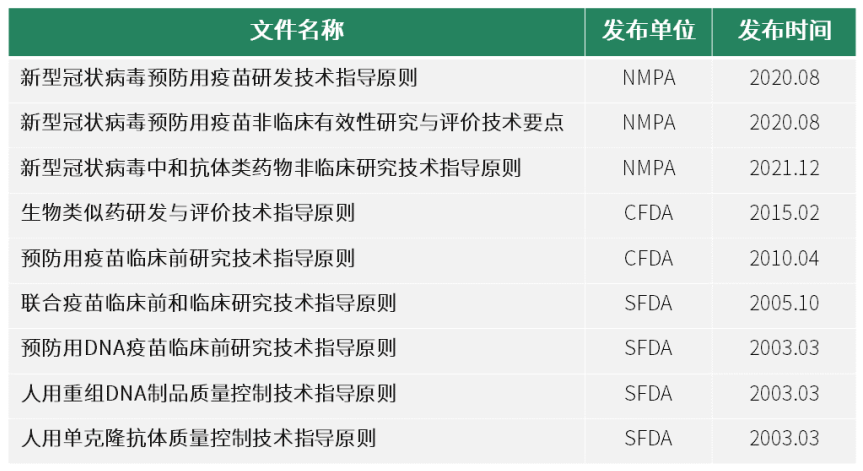
表1 国内已发布的生物大分子药物效学研究相关技术指南
药效研究供试品要求
在药效学试验开始前,应该确保CMC工艺比较成熟,能够稳定地生产目标供试品,并且产品相应的关键质量属性(CQA)能够重现,使之能够充分代表临床拟用样品,尤其是供试品的质量标准最好与临床用样品一致。例如单抗类产品的纯度、活性与药效直接相关,如果供试品与临床用样品的纯度/活性差异太大,会导致药效学试验结果在预测临床拟用剂量或安全性评价时发生较大偏差。
单抗类产品多为注射剂,因此其安全性检项如细菌内毒素、无菌等是保证供试品质量的关键指标,需要严格控制并符合药典标准。其他辅料类,一般要求不应含有抗原性,以免产生抗原抗体进而影响药效。
体外药效和体内药效概述
药效学试验一般分为体外(ex vivo)和体内(in vivo)试验研究。体外试验包括与人源目标靶点/受体的亲和力检测试验、不同种属间抗原结合力检测试验或细胞功能试验、氨基酸序列比对试验,以评价单抗药物的选择性和特异性。如果是免疫激动剂或有相关担忧,还需进行细胞因子释放试验以评价引起细胞因子风暴的可能性。必要时,单抗类药物可直接与人源细胞系、人体组织切片进行结合力试验研究,以直观地评估单抗药物在人体中发挥的药效作用。单抗类药物由于具有Fc功能域,会与 FcγRs 相互作用进而介导有关生物学功能,因此需要考察单抗类药物的抗体依赖的细胞介导的细胞毒(ADCC)效应、抗体依赖性细胞吞噬(ADCP)效应或通过补体活化产生补体依赖的细胞毒(CDC)效应,以及ADCC、ADCP和CDC效应介导靶细胞裂解后可能导致的细胞因子释放效应。
体内试验,需要选择合适的动物模型,通常为目标适应症相关的疾病动物模型。如抗肿瘤药需构建荷瘤动物模型(同源肿瘤模型或异种移植肿瘤模型)来评价药物的抗肿瘤效果,以肿瘤体积、相对肿瘤增值率T/C(%)及抑瘤疗效TGI(%)等指标来综合评价。
若没有相关种属动物时,可以用同源分子药物代替该产品,例如鼠源单抗产品在小鼠体内进行相应的药效学试验。同时,也可通过转基因技术建立表达人源受体的转基因动物进而在转基因动物进行体内药效试验。例如,可用表达人源CLDN18.2分子的转基因小鼠来评价人源化抗CLDN18.2单抗的药效活性。
由于体外药效试验相较于体内药效更加简便快捷,并且更具有可操作性,同时经济实惠,因此,可根据药物特性进行充分的体外药效研究。但由于体外试验不能模拟药物在体内的药代动力学过程,如果药物在动物的体内吸收、分布、代谢等因素对药效有明显影响,则可能影响体外模型对药物体内药效作用的预测价值。因此,无论通过何种方法,终究还是要通过体内药效学研究来验证产品的药物活性作用。
免疫原性对药效的影响
药物的免疫原性是指药物和/或其代谢物诱发对自身或相关蛋白的免疫应答或免疫相关事件的能力。药物免疫原性的大小一般取决于蛋白性质(外源性>内源性,大分子>小分子)、给药途径(皮下注射>静脉注射)、剂量(大剂量>小剂量)以及患者自身的免疫状态和免疫能力等。
药物产生免疫原性的原因众多,例如非全人源化单抗产品较全人源化单抗产品,其免疫原性肯定更大,除此之外,例如来源于生产工艺的污染和杂质(宿主细胞蛋白,宿主细胞DNA、人生长激素),以及蛋白产品不同的糖基化等也可能导致免疫原性。免疫原性问题可能不具有临床相关性,但由于抗药抗体、药物的药动学和药效学互相影响,导致该问题可能会影响药物的临床前药效学和安全性评价。
免疫原性对药效的影响主要是通过产生中和抗体从而降低药效作用,由于中和抗体可能与抗原结构相似的内源性蛋白产生交叉反应,从而产生非预期的不良反应,更有甚者会引起自身免疫疾病和免疫毒性,例如过敏反应和细胞因子释放综合征等;同时非中和抗体也会影响药效,例如会增强或减弱药物药效,影响试验结果的判定,从而使药物的临床使用剂量难以确定,提升临床试验研究的难度。
在药物开发中,需要尽量选择免疫原性潜在风险较小的候选药物,同时也需要探索减少和控制免疫原性不良影响的策略,例如抗药抗体的检测和表征是免疫原性研究的主要手段,具体可参考国家药监局发布的《药物免疫原性研究技术指导原则》。
文 | 柯佳颖
泰格医药注册部
泰格医药注册部有着数百位经验丰富的注册专家,可为全球新药开发提供专业的注册服务。累积项目经验超过了1000个,涵盖各种产品及申报类型。丰富的项目经验使我们能够充分理解各主管当局对申报资料的具体要求,精准把握注册要点,从程序规定、法规要求、技术符合等多层次、多方面保持同客户、药政管理部门的双向有效沟通,通过有效的可行性分析,提供最优注册策略和切实可行的优质服务,保证项目的快速顺畅推进,加快新药开发进程。
注册业务咨询:
justin.zhang@tigermedgrp.com
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。