泰格洞见
看今昔展未来,HER2阳性乳腺癌治疗有何耀眼之处?
2022年12月05日
乳腺癌已超过肺癌成为全球最常见的确诊癌症,2020年全球乳腺癌新发病例估计达230万例,占所有新发癌症病例的11.7%。在中国,乳腺癌则更是位居15-44岁女性癌症死亡原因榜首,且死亡率仍有上升趋势[1]。
乳腺癌的治疗策略因分子特征而异,如雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)以及增殖标志物Ki-67蛋白的表达情况等[2]。其中,高表达HER2的乳腺癌极具侵袭性,曾经一度陷入预后不良的困境。而历经长期摸索,以HER2为靶点的乳腺癌治疗获得重大突破,从首个抗HER2药物曲妥珠单抗获批起,多种抗HER2药物的临床试验取得飞速进展并成为HER2阳性乳腺癌患者的标准治疗方案,同时也催生出更加新颖、更加精准的HER2阳性乳腺癌治疗策略[3]。
来自美国乔治敦大学Lombardi综合癌症中心(LCCC)的Sandra M. Swain等人,对HER2阳性乳腺癌的治疗现状以及新兴策略进行了汇总与讨论,其综述于近期发表在Nature Reviews Drug Discovery上[3]。

图1:论文首页截图
HER2靶点的挖掘
HER家族蛋白属于跨膜受体激酶,包含细胞外配体结合结构域、跨膜结构域以及细胞内酪氨酸激酶结构域。配体与之结合后会诱导其形成同源或异源二聚体,导致下游信号通路的激活,促进细胞分裂和生长并抑制细胞凋亡[4]。
HER家族成员有HER1(EGFR)、HER2、HER3、HER4。目前尚未找到HER2的高亲和力天然配体,不过科学家们发现,HER2常常与其它HER家族蛋白形成异源二聚体。尤其是HER3,因不具有功能性激酶结构域而没有任何催化活性,HER2与HER3便成为彼此形成二聚体的首选[4,5]。
病理学、分子生物学、药物开发领域的创新发展,使HER2阳性乳腺癌治疗已在上个世纪获得举世瞩目的成绩。1978 年,科学家们首次发现EGFR的存在;1984年,科学家们鉴定出HER家族的另一个成员HER2,这一研究领域开始活跃起来[3]。
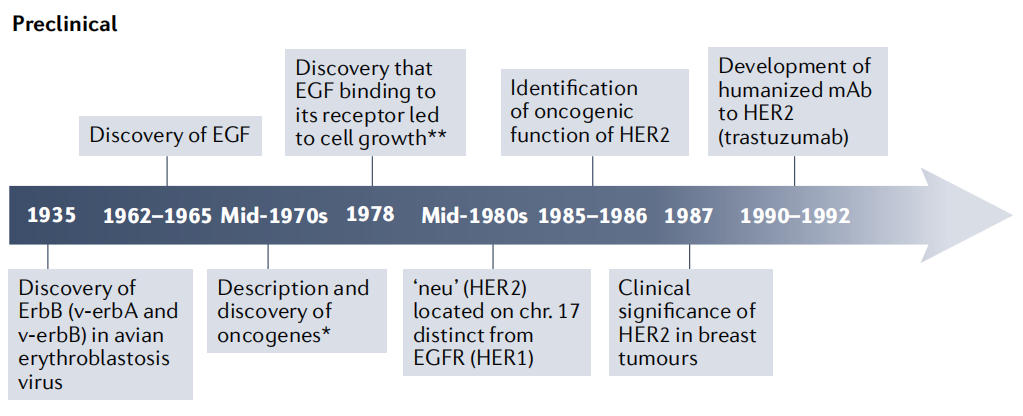
图2:HER2靶点的发现史[3]
随后人们在人类乳腺肿瘤中发现,HER2过表达与乳腺癌患者极差的生存率相关,这在极大程度上推动了以HER2为治疗靶点的策略研发。于是,首个针对HER2的人源化单克隆抗体药物——曲妥珠单抗诞生,于1998年由美国食品药品监督管理局(FDA)批准用于HER2阳性乳腺癌治疗。
HER2阳性乳腺癌的标准治疗
随着对HER2以及HER家族蛋白的理解不断深入,HER2阳性乳腺癌的诊治从初见起色到如今的方兴未艾。
当前,HER2标准检测方法主要包括荧光原位杂交(FISH)检测HER2基因拷贝数、免疫组织化学(IHC)检测HER2蛋白表达情况。其中,FISH检测非常精准,但技术难度高且耗时长、价格昂贵[7];相比之下,IHC检测的问题则是在不同病理实验室间缺乏可重复性[8]。伴随着相关前沿技术的进展,其它检测方法也在不断涌现,以提高HER2检测的准确度和临床实用性。
从治疗角度来看,自曲妥珠单抗之后,以HER2为靶点的药物百花齐放,抗HER2药物成为HER2阳性乳腺癌患者的标准治疗方案,可分为单克隆抗体、酪氨酸激酶抑制剂、抗体偶联药物(ADC)这三种类型。
曲妥珠单抗、帕妥珠单抗这两种单克隆抗体药物,一方面通过作用于HER2的胞外结构域来阻断细胞内HER2信号转导、抑制癌细胞生长,同时还会激活患者自身免疫系统的抗肿瘤活性——引发抗体依赖的细胞介导的细胞毒反应(ADCC)[8,9]。曲妥珠单抗+化疗联合治疗已展现出良好疗效,而与之相比,曲妥珠单抗+帕妥珠单抗+化疗的联合治疗方案在乳腺癌辅助治疗、新辅助治疗以及复发转移性乳腺癌治疗中效果更佳[10]。
Margetuximab也是一种靶向HER2的单克隆抗体药物,其特点则是强化单克隆抗体对HER2阳性肿瘤细胞所介导的ADCC效应,用于与化疗药物联合使用[11]。
在单克隆抗体这条路上,又诞生了两种抗HER2药物研发方向。一种是曲妥珠单抗类似物,其安全性、效力与曲妥珠单抗相似,已获批的药物包括曲妥珠单抗-dkst、曲妥珠单抗-pkrb、曲妥珠单抗-dttb、曲妥珠单抗-qyyp和曲妥珠单抗-anns。另一种是单克隆抗体注射液,将药物以固定剂量组合通过皮下注射方式给药,以减轻患者静脉输注负担,已获批的药物为曲妥珠单抗-透明质酸酶-OYSK皮下注射液,以及帕妥珠单抗-曲妥珠单抗-透明质酸-zzxf皮下注射液。
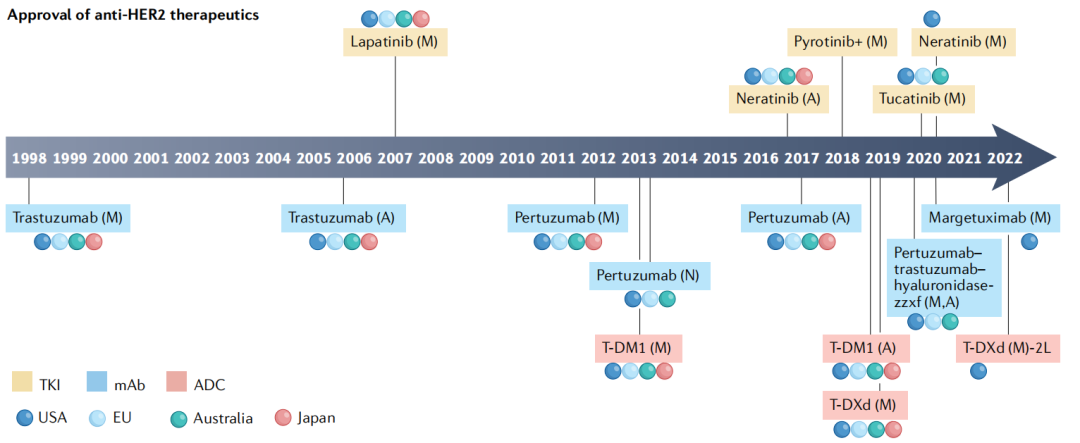
图3:抗HER2药物的发展史[3]
与单克隆抗体不同,酪氨酸激酶抑制剂(TKI)是靶向HER2 细胞内催化激酶结构域的小分子,具备其独特优势。
以Tucatinib为例。高达50%的HER2阳性乳腺癌患者发生脑转移,曲妥珠单抗这类大分子抗体经血脑屏障(BBB)和血肿瘤屏障(BTB)渗透进中枢神经系统时会受到阻碍,而Tucatinib因分子小且活性强,可破解这一难题。对于已接受过抗HER2药物治疗的HER2阳性转移性乳腺癌患者(包括脑转移患者)来说,Tucatinib+曲妥珠单抗+卡培他滨的联合治疗显著延长无进展生存期(PFS)和总生存期(OS)[12,13]。
其它已上市药物的TKI还有拉帕替尼、奈拉替尼、吡咯替尼。
恩美曲妥珠单抗(T-DM1)和T-DXd则属于靶向HER2的ADC药物,同样对HER2阳性转移性乳腺癌患者(包括脑转移患者)具有可观的疗效[14,15]。ADC药物常被誉为“生物导弹”,依靠连接子将单克隆抗体与小分子细胞毒性药物共价结合。一旦ADC药物与肿瘤细胞表面抗原特异性结合,则被内化并释放毒性药物、诱导肿瘤死亡。另外,这些毒性药物还会被靶细胞释放到胞外,从而破坏周围其它没有高表达特异性抗原的肿瘤细胞,起到旁观者效应[16,17]。
当然,抗HER2药物的效果虽好,其治疗相关不良事件(AE)也不可忽视,如诱导心脏毒性、胃肠道毒性、肝毒性、血小板减少症、间质性肺病等。因此,在进行临床决策时,应尽量使得治疗获益最大化、毒性最小化。
抗HER2药物治疗中的耐药机制
尽管取得了这些成功,HER2阳性乳腺癌的临床治疗仍然不可避免地面临着一系列耐药性难题。
在HER2阳性乳腺癌中,编码HER2的基因扩增导致HER2过度表达,促使肿瘤细胞不受控制地增殖。而编码HER家族蛋白的基因发生突变同样会促进乳腺癌进展,且与治疗耐药相关。其中,HER2突变经常与HER3突变同时发生,导致细胞内PI3K–AKT 通路异常激活,因此抗HER2药物与PI3K抑制剂的联合使用被认为是解决这一耐药问题的潜在策略。
其它抗HER2药物治疗耐药机制还包括HER2抗原表位丢失或掩盖(可由黏蛋白4和CD44-透明质酸聚合体过表达所造成)、补偿性信号通路激活、HER2异质性。
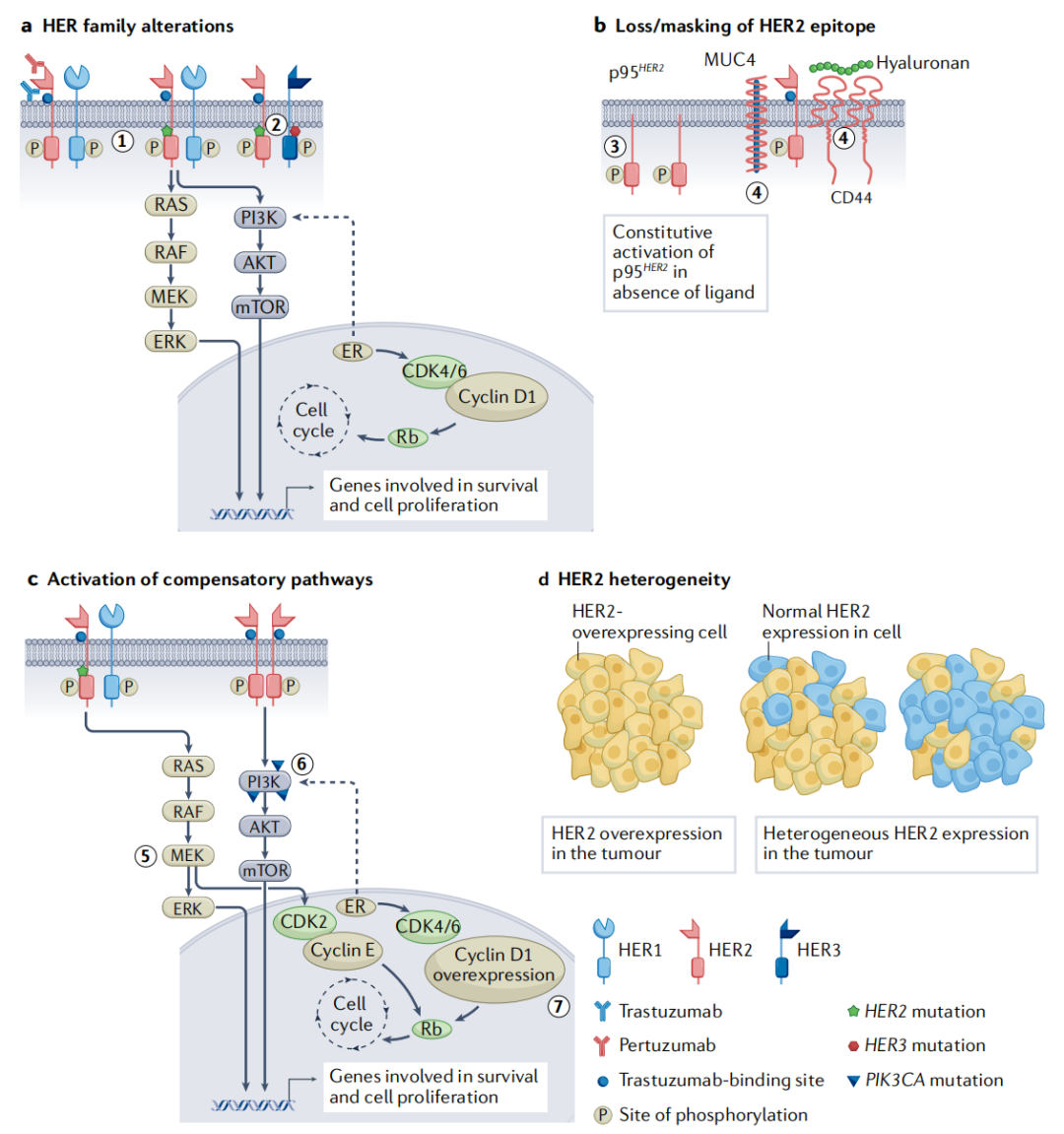
图4:抗HER2药物的耐药机制[3]
另外,肿瘤微环境也与耐药性脱离不了关系,体现于其对曲妥珠单抗所介导的ADCC效应以及抗体依赖的细胞吞噬(ADCP)效应的影响。ADCC是曲妥珠单抗发挥抗肿瘤活性的关键机制,然而在免疫抑制的肿瘤微环境中ADCC效果减弱。如果阻断HLA-G、PD-L1/PD1以解除免疫抑制作用,或可克服曲妥珠单抗治疗乳腺癌的耐药性。
HER2阳性乳腺癌的治疗新策略
纵使HER2阳性乳腺癌“诡计多端”,科学家们也在积极摸索、破解其弱点,并结合新兴技术、多方位角度来开发新的疗法。
前面讲述过,HER2与HER3通常共同形成异源二聚体,介导细胞内下游级联反应。目前,单克隆抗体的研究策略则是打算从HER3下手,利用靶向HER3的抗体来破坏HER2-HER3二聚体的形成(如Seribantumab、Patritumab)。同时,也可改造单克隆抗体以提高其介导的ADCC效应(如Lumretuzumab)。
TKI则是继续发挥其“身材”优势,以其能够穿透血脑屏障的特性,在HER2阳性转移性乳腺癌(包括脑转移)治疗中具有强大吸引力。例如正在开发的新药DZD1516,正是一种口服、可逆、可完全渗透血脑屏障的高选择性HER2小分子TKI。另外,已经在乳腺癌等多种实体瘤中发现HER2的致癌突变,未来靶向HER2的TKI或不再局限于HER2阳性乳腺癌,而是针对具有EGFR、HER2、HER3特定突变的晚期实体瘤(如奈拉替尼)。
近年来,ADC药物热度大升。鉴于恩美曲妥珠单抗和T-DXd的成功,目前有多种靶向HER2的ADC药物正在临床开发中,如Trastuzumab Duocarmazine、ARX788、Zanidatamab zovodotin、HER2-TTC,均处在不同临床试验阶段。已在中国获批用于治疗HER2阳性胃癌、尿路上皮癌的维迪西妥单抗(我国自主研发的ADC药物),也开展临床试验以评估在转移性乳腺癌中的效果。ADC药物的亮点在于能够巧妙利用连接子将小分子细胞毒性药物与靶向HER2的特异性抗体结合起来,实现将各个“组件”叠加在一起后达到更好的效果(可参考前文所述)。选择合适的细胞毒性药物以及抗体是一方面,连接子设计更是ADC药物研发过程中的重头戏[18]。
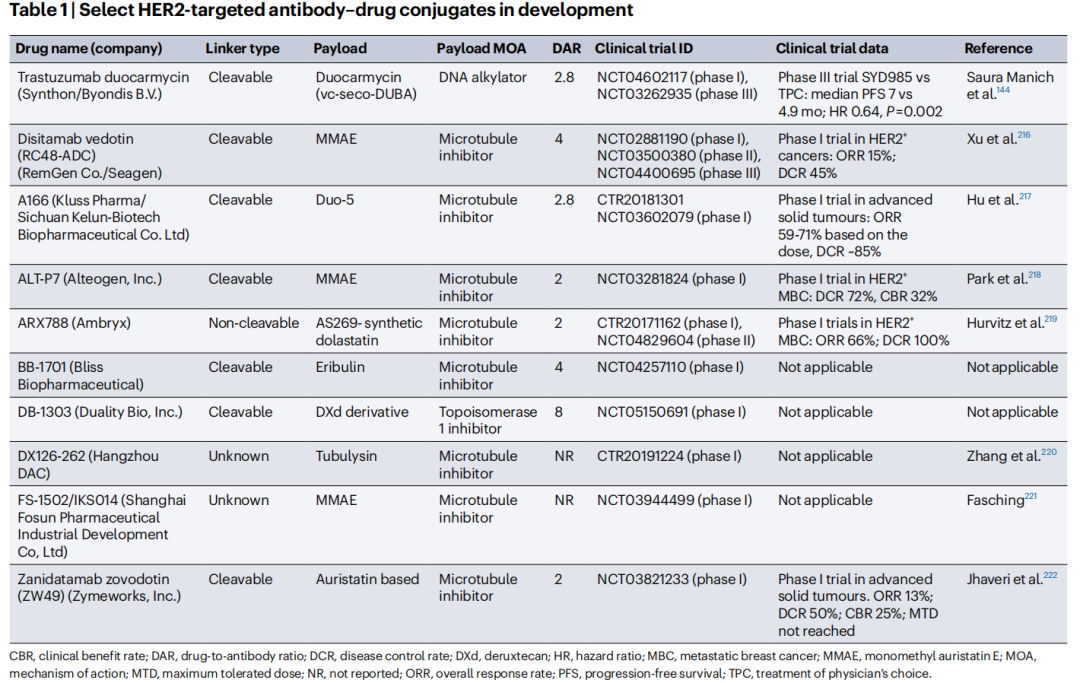
图5:几种靶向HER2的ADC药物正处于不同临床试验阶段[3]
在抗体工程技术的进展下,双特异性抗体也逐渐登上这片舞台。通过对抗体基因进行加工改造和重新装配,双特异性抗体可靶向同一抗原的两个不同表位,如KN026、Zanidatamab,靶向HER2的2个表位;也可同时靶向两个抗原,如Zenocutuzumab,同时靶向HER2和HER3。甚至双特异性抗体还可以一手靶向抗原,另一手靶向免疫检查点,从而引发免疫协同效应,这一应用会在后面进一步说明。
抗HER2药物“新人”还有靶向蛋白质降解药物,能够利用细胞内蛋白质降解途径直接降解靶蛋白。基于这一原理,新药ORM-5029将HER2特异性抗体(Pertuzumab )与靶向GSPT1 蛋白的降解剂(SMol006)偶联在一起,形成抗体-蛋白降解剂偶联药物(AnDC),从而实现选择性地诱导表达HER2的肿瘤细胞死亡。
除了直接靶向HER2并抑制其功能外,科学家们也在想办法利用免疫系统来应对HER2阳性乳腺癌,主要思路包括与免疫检查点抑制剂(CPI)的联合使用、双特异性抗体、免疫刺激抗体偶联物(ISAC)、工程化毒素体(ETB)、CAR-NK细胞疗法或CAR-巨噬细胞疗法、癌症疫苗的研发。
比如刚才提到的双特异性抗体,一方面可以通过同时特异性结合于肿瘤细胞上的HER2以及免疫细胞表面的标志物,来将它们“拷”在一起,有助于免疫细胞激活后释放的细胞因子(TNF 、IFNγ等)裂解肿瘤细胞。另一方面,也可以像药物Cinrebafusp Alfa一样,凭借靶向HER2的部分将药物送至肿瘤微环境中,再依靠靶向T细胞上CD137的部分来改善T细胞耗竭、促进T细胞扩增。
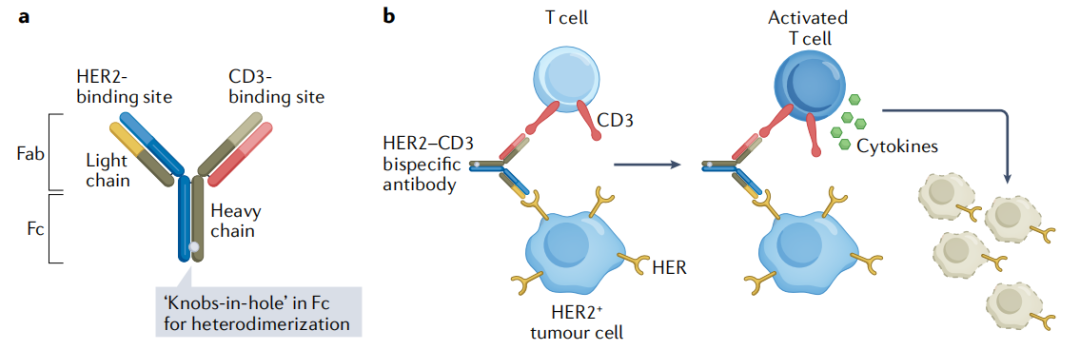
图6:双特异性抗体可同时靶向癌细胞上的HER2以及T细胞上的CD3[3]
总体来说,得益于对HER2的深入了解,以HER2为靶点的治疗已经使得HER2阳性乳腺癌患者的生存率空前提高,当前用于标准治疗的药物包括单克隆抗体、酪氨酸激酶抑制剂以及抗体偶联药物这三大类型。
而随着人们对耐药机制的认知提升、相关新兴技术的成功实现与进展,抗体偶联药物、双特异性药物等抗HER2药物的突破或将HER2阳性乳腺癌治疗引入新的时代,以达到更加精准、更加安全的目标。另外,如何合理将免疫系统利用起来,也为HER2阳性乳腺癌治疗策略带来新的思考。
参考文献:
[1]Hong R, Xu B. Breast cancer: an up-to-date review and future perspectives. Cancer Commun (Lond). 2022 Oct;42(10):913-936. doi: 10.1002/cac2.12358.
[2]Luo, C., Wang, P., He, S., Zhu, J., Shi, Y., & Wang, J. (2022). Progress and Prospect of Immunotherapy for Triple-Negative Breast Cancer. Frontiers in oncology, 12, 919072. https://doi.org/10.3389/fonc.2022.919072
[3]Swain, S.M., Shastry, M. & Hamilton, E. Targeting HER2-positive breast cancer: advances and future directions. Nat Rev Drug Discov (2022). https://doi.org/10.1038/s41573-022-00579-0
[4]Tebbutt, N., Pedersen, M. W. & Johns, T. G. Targeting the ERBB family in cancer: couples therapy. Nat. Rev. Cancer 13, 663e73 (2013).
[5]Baselga, J. & Swain, S. M. Novel anticancer targets: revisiting ERBB2 and discovering ERBB3. Nat. Rev. Cancer 9, 463–475 (2009).
[6]Ballinger, T. J., Sanders, M. E. & Abramson, V. G. Current HER2 testing recommendations and clinical relevance as a predictor of response to targeted therapy. Clin. Breast Cancer
15, 171–180 (2015).
[7]Press, M. F. et al. Diagnostic evaluation of HER-2 as a molecular target: an assessment of accuracy and reproducibility of laboratory testing in large, prospective, randomized clinical trials. Clin. Cancer Res. 11, 6598–6607 (2005).
[8]Baselga, J. Treatment of HER2-overexpressing breast cancer. Ann. Oncol. 21, vii36–vii40 (2010).
[9]Ishii, K., Morii, N. & Yamashiro, H. Pertuzumab in the treatment of HER2-positive breast cancer: 671 an evidence-based review of its safety, eficacy, and place in therapy. Core Evid. 14, 51–70 (2019).
[10]von Minckwitz, G. et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N. Engl. J. Med. 377, 122–131 (2017).
[11]Rugo, H. S. et al. Eficacy of margetuximab vs trastuzumab in patients with pretreated ERBB2-positive advanced breast cancer: a phase 3 randomized clinical trial. JAMA Oncol. 7, 573–584 (2021).
[12]Murthy, R. K. et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N. Engl. J. Med. 382, 597–609 (2020).
[13]Hamilton, E. et al. Tucatinib vs placebo in combination with trastuzumab and capecitabine for patients with locally advanced unresectable or HER2-positive metastatic breast cancer (HER2CLIMB): Outcomes by hormone receptor status. Cancer Res. 81 (Suppl. 4), Abstr. PD3-08 (2021).
[14]Montemurro, F. et al. Trastuzumab emtansine (T-DM1) in patients with HER2-positive metastatic breast cancer and brain metastases: exploratory final analysis of cohort 1 from KAMILLA, a single-arm phase IIIb clinical trial. Ann. Oncol. 31, 1350–1358 (2020).
[15]Jerusalem, G. H. M. et al. Trastuzumab deruxtecan (T-DXd) in patients with HER2 metastatic breast cancer with brain metastases: a subgroup analysis of the DESTINYBreast01 trial. J. Clin. Oncol. 39, 526 (2021).
[16]Beck, A., Goetsch, L., Dumontet, C. & Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nat. Rev. Drug. Discov. 16, 315–337 (2017).
[17]Staudacher, A. H. & Brown, M. P. Antibody drug conjugates and bystander killing: Is antigen-dependent internalisation required? Br. J. Cancer 117, 1736–1742 (2017).
[18]Su, Z. et al. Antibody-drug conjugates: recent advances in linker chemistry. Acta Pharmaceutica Sin. B 11, 3889–3907 (2021).
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。