泰格洞见
基于风险的质量管理(RBQM)中国策略探索和实践,全力助推临床研究丨2022 DIA大会
2022年12月19日
在临床试验日趋复杂、质量管理方法日益提升的环境下,基于风险的质量管理(Risk-Based Quality Management, RBQM)已成为行业先进的质量管理理念,它以风险评估为基础,通过数字化、智能化、前瞻性的方式将“质量源于设计”纳入试验设计和质量管理计划的设计中,使临床试验中质量管理活动(如监查、质量控制访视、稽查等)的关注点和活动聚焦于对受试者安全和数据质量有最大影响的方面。
自2013年EMA与FDA 推荐采用 RBQM/RBM 以来,全球范围内要求革新监查方式的呼声越来越高。中国也于2020年发布新版 GCP 并提及 RBQM(第31条),其中明确提出采用系统的、基于风险的方式对临床试验进行监查。为了促进与指导申办者在临床试验过程中对中心化监查的实践与应用,CDE 也组织制定《药物临床试验中心化监查统计指导原则(试行)》并于2022年1月正式发布。
近日,中国国际药物信息大会暨 2022 DIA 中国年会以“创新守护健康、合作引领未来”为主题,围绕药物全生命周期开展相关专题领域内容的交流和讨论在线上召开。泰格医药副总裁、数统事业部副总经理陈丽花女士于12月11日在 DIA 中国年会上,就生物统计领域,发表“基于风险的质量管理(RBQM)中国策略探索和实践”的主题发言, 向业界同仁分享了 RBQM 中国实践的相关情况,并探讨了未来的发展方向。以下为分享内容整理:

图源:DIA直播
RBQM实施现状:海外已经广泛应用 国内学习热情高涨
TransCelerate 于2020年邀请其成员公司(多数为头部医药公司)就 RBQM 实施现状进行了调研,并在2021年对行业发布。结果显示,国际上,RBQM 的实施程度相当高。在接受调研的企业中,90%的美国公司已经至少在50个试验中应用 RBQM。
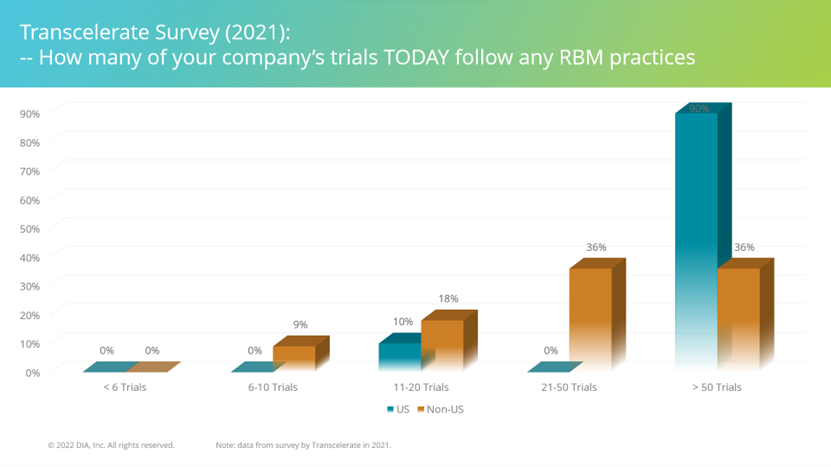
关于是否使用 RBQM 的影响因素方面,相较于I期健康人试验与非干预性试验,RBQM 更常应用于患者参与的试验(II期和III期)和干预性试验。企业希望通过实施 RBQM,更好地保障患者权益、试验方案依从与数据完整性。此外,受试者数量与研究中心数量也是影响是否使用 RBQM 的重要因素。
在实施 RBQM 的试验中,最广泛应用的模块包含针对性/部分 SDV(Targeted/Reduced SDV)、远程监查(Remote Monitoring)、关键风险指标(KRI,Key Risk Indicator)与试验风险评估(Trial Level Risk Assessment),四者应用比例分别为95%、95%、95%与90%。其它常用的RBQM模块包含中心化统计监查(CSM,Central Statistical Monitoring)、针对性SDR(Targeted SDR)、基于风险的动态现场监查(Monitoring Frequency by Site Level Risk)、质量容忍度(QTL,Quality Tolerance Limits)等。
近年来,海外 RBQM 相关的研究和成果应用引人注目,国内探索 RBQM 的热情也空前高涨。DIA 中国多次组织相关的行业研讨会,共同交流探讨成功经验与发展策略。目前 RBQM 在中国的实施整体处于起步阶段,各企业应切合自身需求与能力,可按照问题管理、风险管理、中心化监查、分层数据审查、智能数据分析五大阶段逐级实施,最终实现 RBQM 的全效能。
RBQM泰格方案:丰富的临床试验一体化服务经验 持续升级的数智化创新方案
依托自身丰富的临床试验一体化服务经验,结合国际先进经验和国内需求,泰格医药正不断完善符合监管法规与试验需求的 RBQM 解决方案,为申办方提供高质量的 RBQM 服务。
1、服务内容
泰格医药立足于临床试验降本增效的核心需求,深度秉持风险管理理念,制定了包含风险评估、中心化监查、现场监查、远程监查等模块的 RBQM 业务架构。
风险评估:在试验启动前介入,定义关键数据和流程,评估项目风险,通过更新方案设计或其他措施缓解或规避风险,为试验的成功奠定良好基础;
中心化监查:从多维度定义指标,结合有效的各类数据分析方法,在试验执行过程中识别从试验数据和运营管理数据中反映出的各种异常信号,动态监控风险或识别潜在问题。当触发预警后,项目团队可结合现场监查、远程监查,及时采取措施降低风险,实现对试验的高质量管理。
现场监查/远程监查:结合中心化监查,可降低现场监查的覆盖面,指导现场监查方向,执行针对性/部分 SDV 策略。同时,中心化监查也可以为远程监查的内容和要求提供指引。
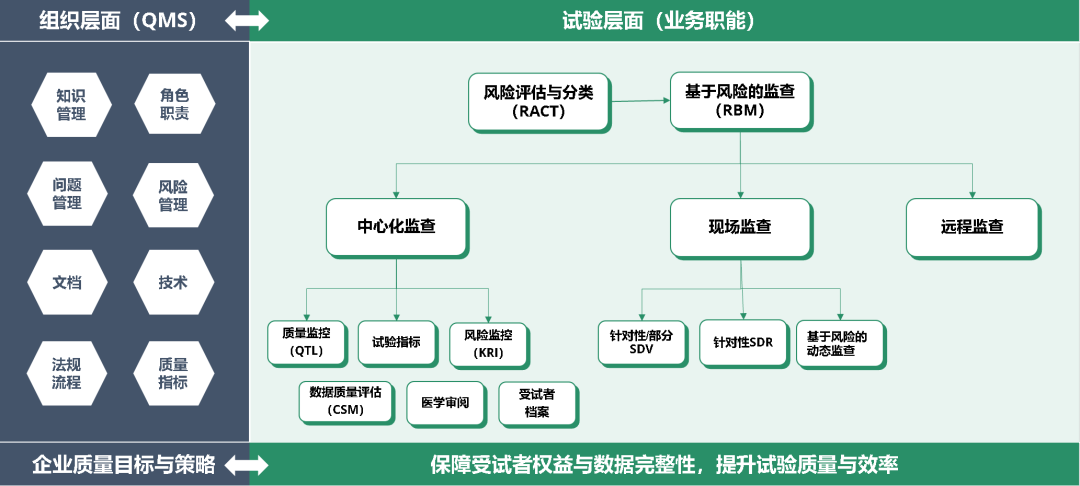
图:泰格RBQM体系
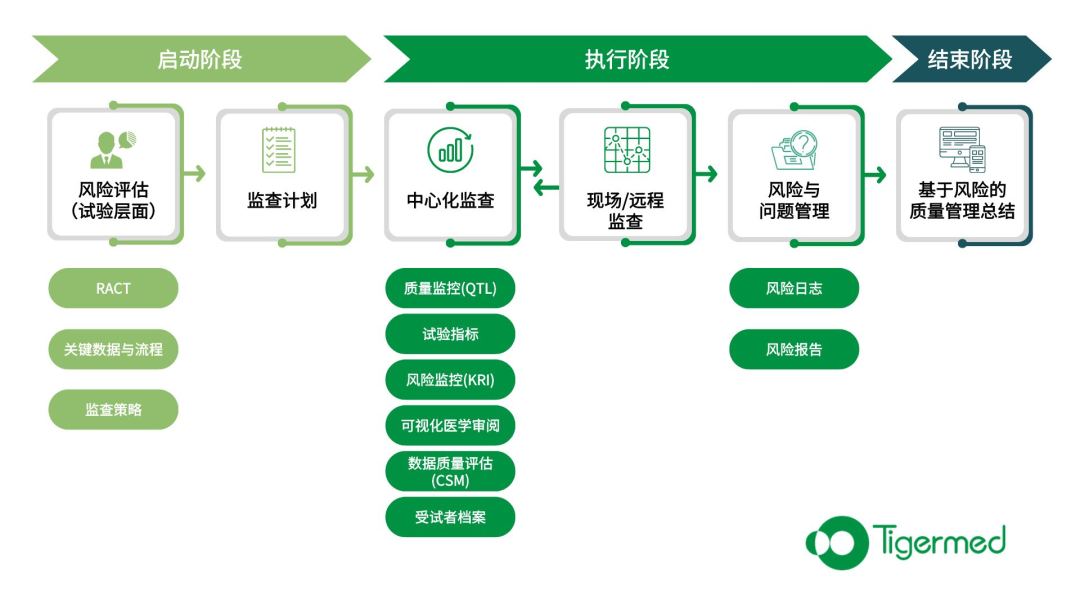
图:泰格RBQM流程
2、数智化平台
泰格医药持续地在解决方案和临床试验实践方面投入了大量的人力、物力资源,并于2022年8月上线发布了自主研发的 RBQM 系统(II期)。本期系统主要满足中心化监查的数据分析、风险可视化与风险缓解管理等功能。丰富的多维度风险可视化呈现,可帮助试验团队更快速、更准确掌握试验与研究中心的风险分布与程度,进而制定有效的质量风险管理措施。
此外,系统从用户的访问控制、稽查留痕、数据备份与恢复机制等多方面实现系统安全管理,保障数据的隐私与完整,为高质量的 RBQM 实施保驾护航。

3、实践案例
目前,泰格医药已为一些 MNC(跨国公司)和国内 Biotech 提供了 RBQM 服务。在本次大会上,陈丽花女士以几个真实案例为大家阐述了 RBQM 是如何在临床试验中发挥有效的监查作用并提升临床试验质量。
例如,通过对 AE 发生率分析,项目组可以快速聚焦发生率偏高或偏低的研究中心,并通过进一步的调查研究,以识别是否存在受试者安全性保护不佳或AE或漏报的情况。
又例如,在某项试验中,通过综合对比不同研究中心在 SDV 完成率、SDR 完成率、数据录入率三个 KRI 上的表现,发现某个研究中心存在高风险,从而提醒管理团队及时关注该研究中心是否由于入组速度过快而导致资源配置不足。
总结与展望:挑战与机遇共存 仍需持续努力
会议尾声,陈丽花女士总结了当前 RBQM 中国实践的优势与困惑:中国医药行业发展势头迅猛,企业提质降本的需求持续攀升,加上行业思路不断开拓以及国外已有相对成熟的经验可供借鉴,这些因素对助推 RBQM 在中国快速落地有重要影响。新机遇同时意味着新挑战,法规要求、思维转变、与传统模式相冲突、以及数据获取等方面,仍是 RBQM 中国实践未来亟待解决的关键问题。
对于 RBQM 中国落地发展的努力方向,陈丽花女士从体系层面与技术层面谈到:
体系层面
企业需合理调整业务体系与流程,为 RBQM 的实施创造良好的基础条件;
各角色应勇于躬身入局,积极投入 RBQM 的探索与实践;
技术层面
加快临床试验数字化转型,打破数据孤岛,进一步提升数据流的获取与分析;
加强统计学方法的研究与应用,实现更早地、更精准地发现临床试验质量问题。
RBQM 中国实践的落地之路上,前路壁垒重重,笃行方可致远。未来,泰格医药将持续探索创新前沿,为加速新药研发进程贡献智慧与力量。
文| 马思懿 谢晓梅
责编 | 徐海涛
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。