泰格洞见
「潜力股」NK细胞,或成实体瘤治疗领域的新生力量
2022年12月14日
目前,肿瘤逐渐成为全球的主要公共卫生问题,据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球最新癌症负担数据显示,2020年全球新发癌症病例1929万例,癌症死亡病例996万例[2]。
近年来,针对肿瘤的治疗方案也正处于不断扩展中。在这其中,细胞免疫治疗的各项研究进展尤为值得关注。2011年,Nature 发文表示细胞免疫治疗未来或可治愈癌症;2013年,细胞免疫治疗荣登 Science 杂志十大科技突破之首……细胞免疫治疗近年来的发展迅速,其主要包括非特异性和特异性两大类。
表1 细胞免疫疗法主要分类
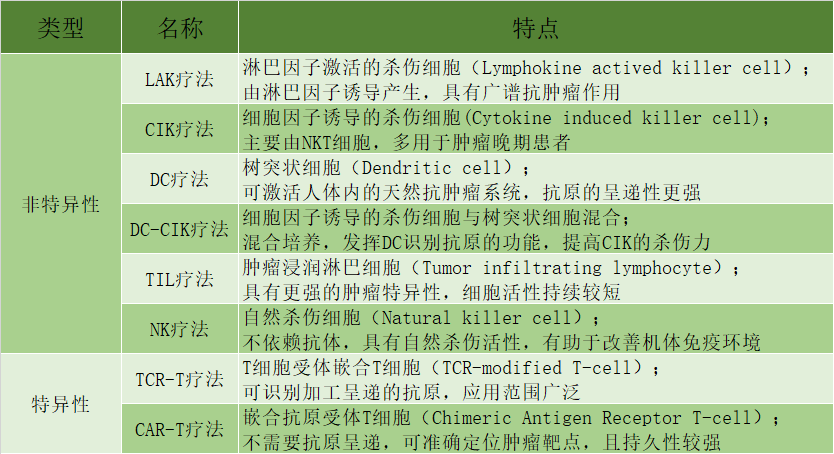
资料来源:[3]
由于NK细胞的独特生物学特性和多种作用机制,NK细胞疗法近年来逐渐受到广泛关注,或成肿瘤治疗领域的“明日之星”。作为人体抵御病毒感染和癌细胞的第一道防线,NK细胞具有对肿瘤的直接溶解活性,可非特异性直接杀伤肿瘤细胞,在控制肿瘤的发展和转移中发挥关键作用。随着研究人员对NK细胞作用机制了解的不断深入,基于NK细胞的免疫疗法逐渐在肿瘤治疗领域显示出巨大的治疗潜力。
“人体第一道防线” NK细胞,当之无愧的“肿瘤杀手”
NK细胞具有天然的杀伤活性,可以独立识别并杀伤病毒和癌细胞,堪称人体内的“天然杀手”。NK 细胞具有多种细胞毒性机制和通过细胞因子产生调节免疫反应的能力,在抗癌免疫中起着举足轻重的作用。
作为人体的第一道防线,NK细胞的作用包括分泌穿孔素、颗粒酶、颗粒溶素等具有细胞毒性的溶解性颗粒,诱导靶细胞凋亡;表达TNF超家族成员结合相应受体诱导靶细胞凋亡;分泌大量细胞因子、生长因子和趋化因子,招募巨噬细胞、DC细胞、T细胞等协同作战;表达Fc受体,介导ADCC效应[4]。由于其具备广谱的抗肿瘤作用,基于NK细胞的治疗策略潜力广受关注。
根据设计思路的差异,基于NK细胞的免疫疗法主要细分为五种,分别是细胞因子疗法、NK细胞的过继性细胞疗法、基因工程化NK细胞疗法、单克隆抗体疗法、NK细胞衔接器。
表2 基于NK细胞的五种治疗策略

资料来源:[5]
与其他肿瘤免疫疗法相比,基于NK细胞的免疫疗法存在诸多显著优势。
实体瘤治疗领域,NK细胞疗法颇具潜力
基于NK细胞的免疫疗法在实体瘤治疗领域表现不俗。根据相关研究表明,具有延长晚期非小细胞肺癌(NSCLC)患者生存期潜力的NK细胞也可表达PD-1。基于此,来自广东省蛋白质组学终点实验室的研究人员试图分析帕博利珠单抗协同同种异体NK细胞在既往接受过治疗的晚期NSCLC患者中的安全性和有效性。相关研究结果以“Pembrolizumab plus allogeneic NK cells in advanced non-small cell lung cancer patients”为题发表在The Journal of Clinical Investigation上。

图1 有关研究成果(图源:[6])
在安全性方面,整个试验过程中,患者治疗的耐受性良好,没有严重副作用。
在有效性方面,研究人员发现在接受NK细胞协同帕博利珠单抗联合治疗之后,患者体内NK细胞的积累显著增加,且Th1细胞因子水平显著升高,抗癌效果增加。具体表现为:NK细胞疗法和帕博利珠单抗联合治疗组患者的肿瘤缩小显著,其客观缓解率是帕博利珠单抗治疗组的两倍;与帕博利珠单抗治疗组相比,联合治疗组患者体内的肿瘤标志物、循环肿瘤细胞都显著降低;与帕博利珠单抗治疗组相比,联合治疗组患者的总生存期和无进展生存期都显著延长。

图2 治疗前和治疗90天后,患者的免疫参数、肿瘤标志物和CTC评估(图源:[6])
总体来说,这项研究结果无疑是振奋人心的,其证实了帕博利珠单抗协同NK细胞疗法可以显著增强抗肿瘤效果,同时没有使患者产生严重的副作用。基于此,今后在临床上使用抗PD-L1/PD-1抗体与NK细胞疗法联合治疗先前接受过治疗的晚期 NSCLC 患者成为可能。
此外,NK细胞疗法在治疗黑色素瘤中也颇具潜力。来自圣路易斯华盛顿大学医学院的研究团队发现,NK细胞疗法可以显著缩小患有晚期黑色素瘤小鼠体内的肿瘤大小,且可有效阻止肿瘤复发,据此,他们认为NK细胞疗法在治疗黑色素瘤方面十分有效。相关研究成果以“Memory-like Differentiation Enhances NK Cell Responses to Melanoma”为题,发表在Clinical Cancer Research上。

图3 有关研究成果(图源:[7])
这项研究证明了IL2、IL5和IL8受体诱导健康供体和晚期黑色素瘤患者的记忆NK细胞表现出增强的攻击黑色素瘤靶点的能力,为使用记忆NK细胞作为替代免疫疗法来治疗对标准疗法具有耐药性的晚期黑色素瘤患者提供了依据,支持黑色素瘤首次人体试验的进展。
在此值得一提的是,在基于NK细胞的肿瘤治疗策略中,CAR-NK细胞疗法又是一个热点话题。近年来,CAR-NK细胞疗法已经在乳腺癌、卵巢癌、胰腺癌、胶质母细胞瘤等肿瘤类型中进行了广泛的研究,且也都取得了不错的结果。
基于NK细胞的免疫疗法如今在实体瘤治疗领域的研究还正处于不断深入和扩增之中,其可治疗的肿瘤类型也在不断增多,随着对NK细胞疗法研究的加深,其定会在实体瘤治疗领域大放异彩。
作为实体瘤治疗的新生力量,NK细胞疗法未来或将大放异彩
虽然全球范围内多家药企布局NK细胞疗法,但目前来说,NK细胞疗法仍处于初步发展阶段,大部分NK细胞疗法处于Ⅰ、Ⅱ期临床研究阶段。早期结果显示出NK细胞疗法在实体瘤治疗方面效用良好且兼具安全性,被认为是针对实体瘤的首选细胞免疫疗法。
2022年7月,Celularity宣布其NK细胞疗法CYNK-101的Ⅰ/Ⅱa期临床试验完成首例患者给药,用于晚期HER2阳性胃癌或胃食管交界处癌症的一线治疗。该疗法已于同年2月15日被FDA授予孤儿药资格,与标准化疗、抗HER2抗体曲妥珠单抗和PD-1抑制剂Keytruda联用,一线治疗局部晚期不可切除或转移性晚期HER2阳性胃癌或胃食管结合部腺癌患者。
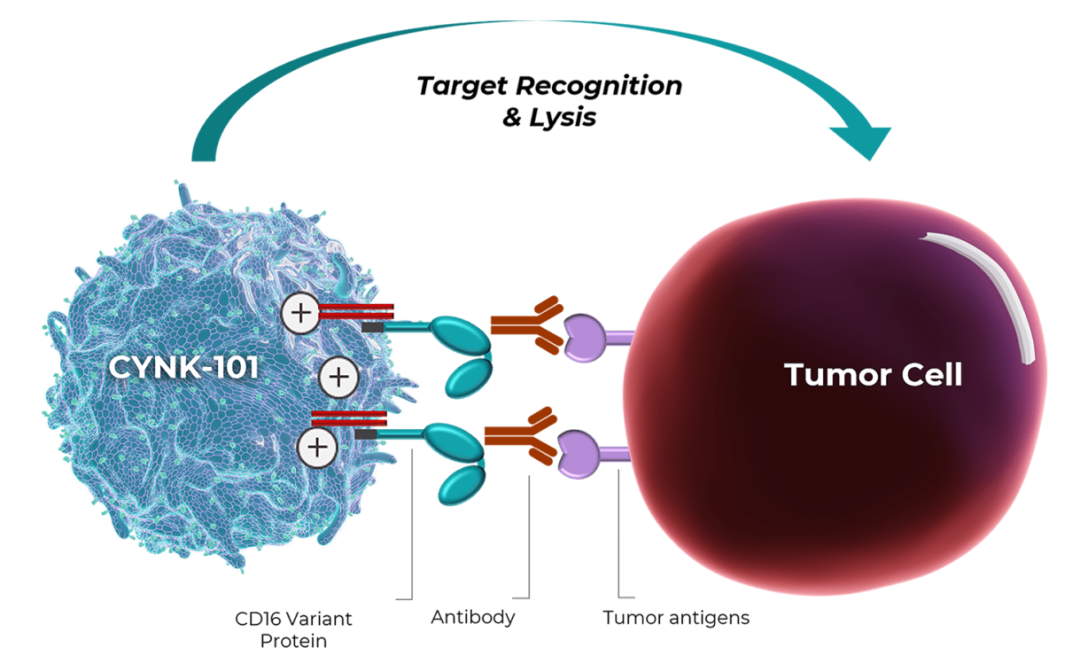
图4 CYNK-101的作用机制(图源:Celularity官网)
据Celularity官网显示,CYNK-001是唯一一种从胎盘造血干细胞开发的冷冻保存、同种异体、现成的NK细胞疗法,可作为各种血液癌症、实体瘤和传染病的潜在治疗选择。目前,该公司正在临床研究CYNK-001作为多种癌症适应症的治疗方案,包括多发性骨髓瘤、急性髓性淋巴瘤和多形胶质母细胞瘤以及新冠病毒。
2022年10月,NKGen Biotech宣布FDA批准其冷冻保存的“现成的”异体血源NK细胞疗法SNK02的Ⅰ期临床研究,以评估该疗法对难治性实体瘤受试者的安全性和耐受性。冷冻保存使细胞能够保持显著的细胞毒性,这使SNK02成为治疗实体瘤的理想临床候选药物。据称,SNK02是首个冷冻保存的异体NK细胞疗法,与其他细胞疗法不同的是,SNK02在给药前不需要清淋处理。在6月份的2022年美国临床肿瘤学会年会上,NKGen Biotech公布了SNK01疗法的Ⅰ期临床试验结果。结果显示,SNK01 联合 avelumab 在 17 名晚期癌症患者中都显示出疗效,客观缓解率为11.7%,中位无进展生存期为11.3周,中位生存期为24.9周;患者对SNK01与avelumab的联合治疗耐受性良好;SNK01可以使快速进展的疾病保持稳定,同时允许使用细胞毒性化学疗法进行额外治疗[8]。
如今NK细胞疗法的研发可以说是“百花齐放”,除以上两款产品,还有多款药物正处于临床发展阶段。
表3 实体瘤治疗领域NK细胞疗法在研药物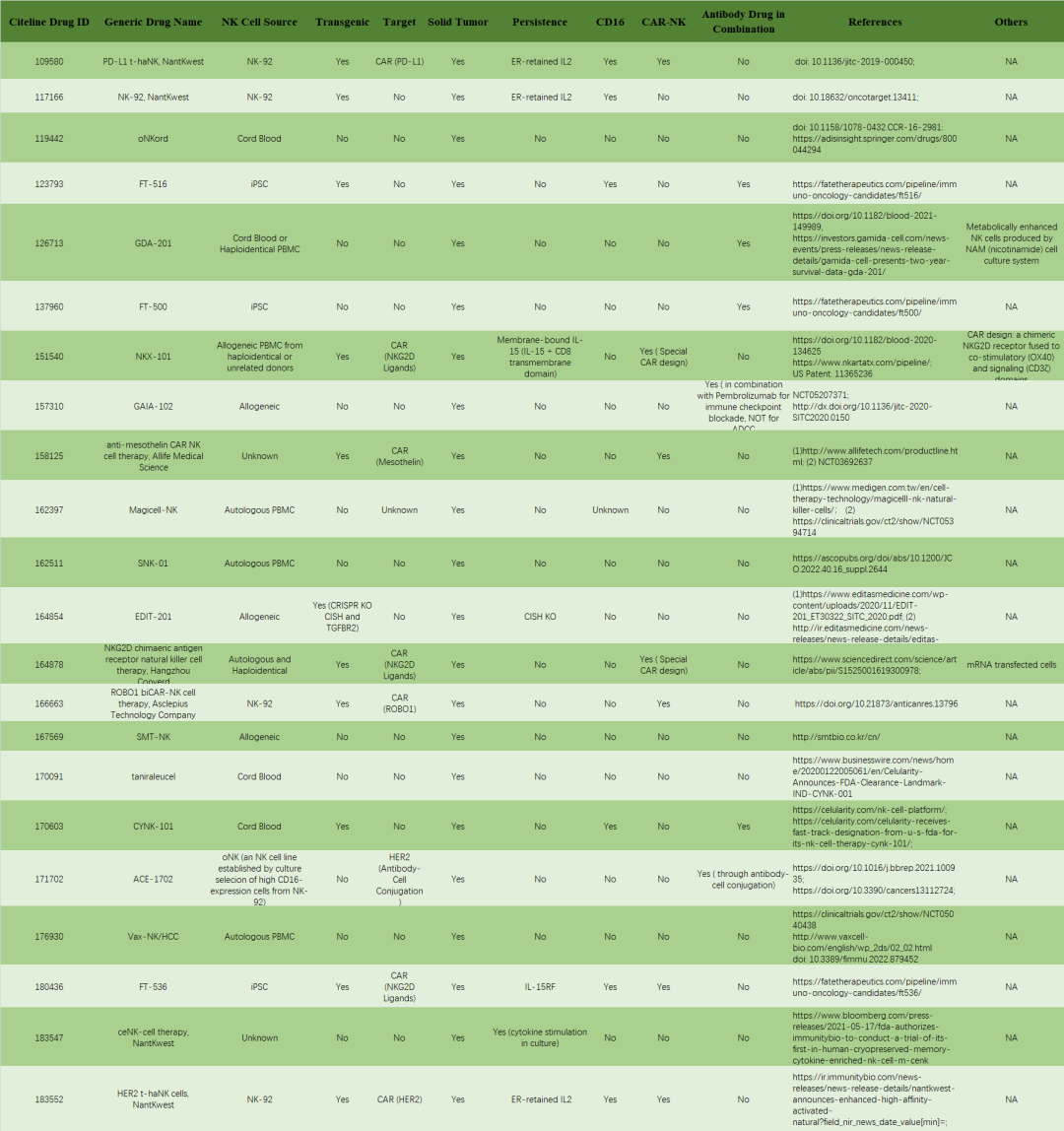
资料来源:[9]
注:因数据来源限制及更新速度,或存在不完全统计情况。
在投融资方面,NK细胞疗法也是深获药企青睐。今年10月,由基因编辑技术CRISPR先驱、诺贝尔奖得主Jennifer Doudna创建的Scribe Therapeutics与赛诺菲达成合作协议,赛诺菲将使用Scribe开发的CRISPR基因组编辑技术改造创新NK细胞疗法以对抗肿瘤。此次与Scribe的合作是赛诺菲在CAR-NK细胞疗法上的持续深耕。
此外,6月,致力于开发NK细胞疗法的生物技术公司Artiva Biotherapeutics宣布完成7800万美元的A轮融资,用于开发与单抗联用的NK细胞疗法以及CAR-NK细胞疗法。
NK细胞疗法在研产品众多,且颇受资本青睐,以上我们仅仅列出其中几个在研产品以及近期的投融资情况,但也足以看出NK细胞疗法的发展前景向好。尽管在研产品众多,但目前尚未有上市产品。
以上分析了NK细胞疗法的优势、研究进展以及在研产品,看到了NK细胞疗法在实体瘤免疫治疗领域的巨大潜力,未来或将成为实体瘤治疗领域的“明日之星”。
但同时,也需要看到NK细胞疗法的研发及应用也存在诸多挑战。比如,体外扩增困难,不管是什么来源的NK细胞,扩增都是目前面临的一个较大难点;尽管NK细胞杀伤范围广泛且速度迅速,但持续性较弱;NK细胞的转染效率有待提升,NK细胞是先天性免疫细胞,对外来病毒或质粒存在抵抗作用,转染进病毒的NK细胞甚至都可能会被其他NK细胞识别为变异细胞而清除。基于此,以上这些问题的存在极大可能会降低NK细胞疗法的成本优势以及患者的使用依从性。
希望随着研究人员的探索,可以不断战胜NK细胞疗法目前面临的挑战,加快药物研发进展,尽快应用到临床,造福诸多肿瘤患者。
参考资料:
[1]Torre L A, Bray F, Siegel R L, et al. Global cancer
statistics, 2012 [J]. CA: A Cancer J Clin, 2015, 65(2):
87-108.
[2]Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chin Med J (Engl). 2021 Mar 17;134(7):783-791. doi: 10.1097/CM9.0000000000001474. PMID: 33734139; PMCID: PMC8104205.
[3]http://pdf.dfcfw.com/pdf/H3_AP202008181399359306_1.pdf
[4]Björkström NK, Ljunggren HG, Michaëlsson J. Emerging insights into natural killer cells in human peripheral tissues. Nat Rev Immunol. 2016 Apr 28;16(5):310-20. doi: 10.1038/nri.2016.34. PMID: 27121652.
[5]马洁,刘彩霞,谭琴,昌晓红,程洪艳,王征旭,游嘉,武立华,程金莲,童春容,吴迪,王少华,曹彩.免疫细胞治疗临床研究及相关产业现状与未来发展趋势[J].药物评价研究,2021,44(02):234-242.
[6]Lin M, Luo H, Liang S, et al. Pembrolizumab plus allogeneic NK cells in advanced non-small cell lung cancer patients. J Clin Invest. 2020 May 1;130(5):2560-2569. doi: 10.1172/JCI132712. PMID: 32027620; PMCID: PMC7190908.
[7]Marin ND, Krasnick BA, Becker-Hapak M, et al. Memory-like Differentiation Enhances NK Cell Responses to Melanoma. Clin Cancer Res. 2021 Sep 1;27(17):4859-4869. doi: 10.1158/1078-0432.CCR-21-0851. Epub 2021 Jun 29. PMID: 34187852; PMCID: PMC8416927.
[8]https://nkgenbiotech.com/nkgen-biotech-to-present-snk01-clinical-data-at-the-2022-asco-annual-meeting/
[9]Wang S, Chen K, Jiang Y, et al. Breaking boundaries: Current progress of anticancer NK cell-based drug development. Drug Discov Today. 2022 Nov 10:103436. doi: 10.1016/j.drudis.2022.103436. Epub ahead of print. PMID: 36370993.
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。