泰格洞见
作为癌症治疗的革命性突破,免疫检查点治疗的路在何方?
2023年09月07日
免疫检查点治疗(Immune Checkpoint Therapy,ICT)通过阻断或刺激免疫通路,增强人体免疫系统对肿瘤的抑制或杀伤活性。CTLA-4/B7-1 和 PD-L1/PD-1 的发现是肿瘤免疫治疗的革命性突破,引发了免疫检查点的研究热潮。在过去的十年中,免疫检查点抑制剂(Immune Checkpoint Inhibitors,ICIs)已成为化疗/靶向治疗、放疗和手术之后,癌症治疗的第四大支柱。临床使用 ICIs 过程中,在部分转移性癌症患者中观察到长期临床反应,但大多数患者没有反应,一部分患者在最初治疗有效后,对 ICIs 产生了耐药性。因此,全面了解对 ICT 反应或抵抗的免疫和非免疫调节因子,对于 ICT 充分发挥作用至关重要。
近期,美国德克萨斯大学 MD 安德森癌症中心研究团队在 Cell 发表了题为“Immune checkpoint therapy-current perspectives and future directions”的综述,系统阐述了免疫检查点分子的作用机制和 ICT 临床进展,概述了 ICT 的重大挑战和应对策略。

▲图1 研究成果(图源:[1])
T 细胞相关的免疫检查点治疗
T 细胞是抗肿瘤免疫的关键。T 细胞的激活包括两个主要信号:①通过T细胞受体(T Cell Receptor,TCR)与抗原呈递细胞(Antigen Presenting Cell,APC)上的主要组织相容性复合体及其同源肽抗原的相互作用;② T 细胞表达的共刺激受体 CD28,与 APC 上表达的 B7 共刺激分子家族结合,诱导T细胞分化并克隆扩增形成效应细胞,驱动抗肿瘤免疫反应。激活T细胞后,共抑制性分子也相应上调如 CTLA-4、PD-1/PD-L1,以减弱 T 细胞的活化,防止损害正常细胞。
CTLA-4 是典型的抑制性分子,在活化T细胞和调节性T细胞上高表达,并在T细胞活化后约 48~72h 达到峰值。CTLA-4 是 CD28 的同源物,但与 CD28 相比,CTLA-4 与 APC 的 B7-1(CD80)和 B7-2(CD86)分子有更高亲合力,并竞争性抑制共刺激 CD28 信号,调节 APC 诱导的 T 细胞反应,抑制活化 T 细胞不受控制的扩增。
PD-1 及其配体 PD-L1 和 PD-L2 是重要的负性免疫调节因子,PD-1 在肿瘤浸润性T细胞(包括耗竭性T细胞)中高度表达,PD-L1 主要在非淋巴组织中广泛表达。肿瘤细胞可通过其表面表达的 PD-L1,与 T 细胞表面 PD-1 受体结合,经过细胞内信号传递,抑制 T 细胞功能,导致肿瘤细胞免疫反应受损及对常规放化疗的抵抗。PD-1 与 PD-L1 结合可抑制 TCR 信号传导,从而调节 T 细胞反应的效应期。
PD-1 和 CTLA-4 虽然都是抑制性分子,但作用机制不同。CTLA-4 抑制剂主要在 T 细胞启动中发挥作用,并扩大克隆多样性,也可促进 T 细胞转运至免疫学上的“冷”肿瘤。PD-1/PD-L1 抑制剂主要影响耗竭型 CD8+T 细胞,既不会扩大克隆多样性,也不会促进 T 细胞向肿瘤的转运。
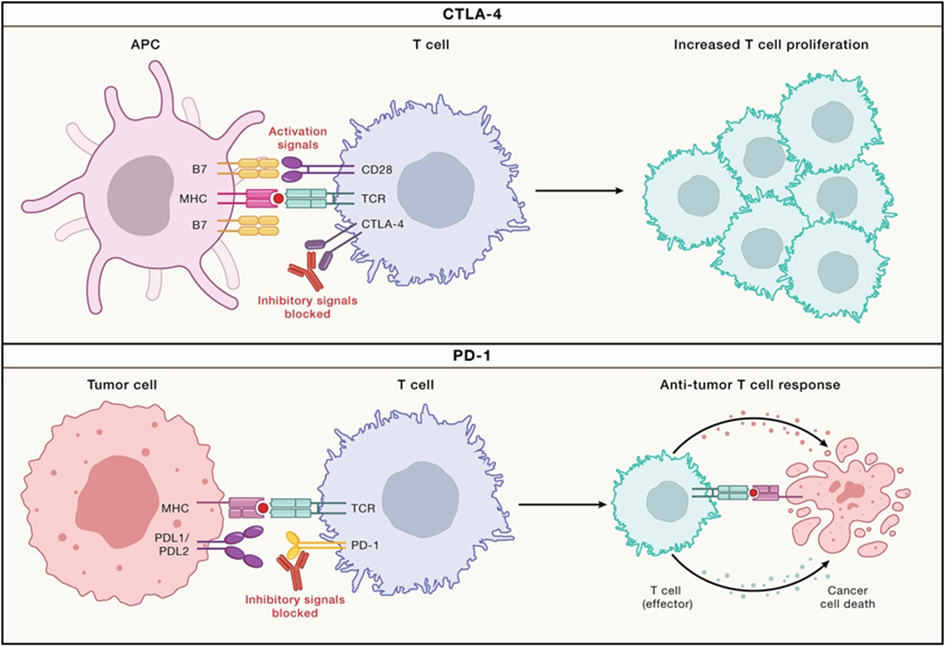
图2 CTLA-4和PD-1在作用机制上的差异(图源:[1])
除了 CTLA-4 和 PD-1 外,多种新的免疫调节分子正在研究,包括淋巴细胞活化基因3(Lymphocyte-activation Gene 3,LAG-3)、T细胞免疫球蛋白黏蛋白-3(T Cell Immunoglobulin and Mucin-domain Containing-3,TIM-3)、免疫受体酪氨酸抑制位点结构域蛋白T细胞免疫受体(T Cell Immunoglobulin and Immunoreceptor-tyrosine-based-inhibitory-motif Domain,TIGIT)、诱导T细胞共刺激剂(Inducible T Cell Costimulator,ICOS)、4-1BB 和 OX-40。
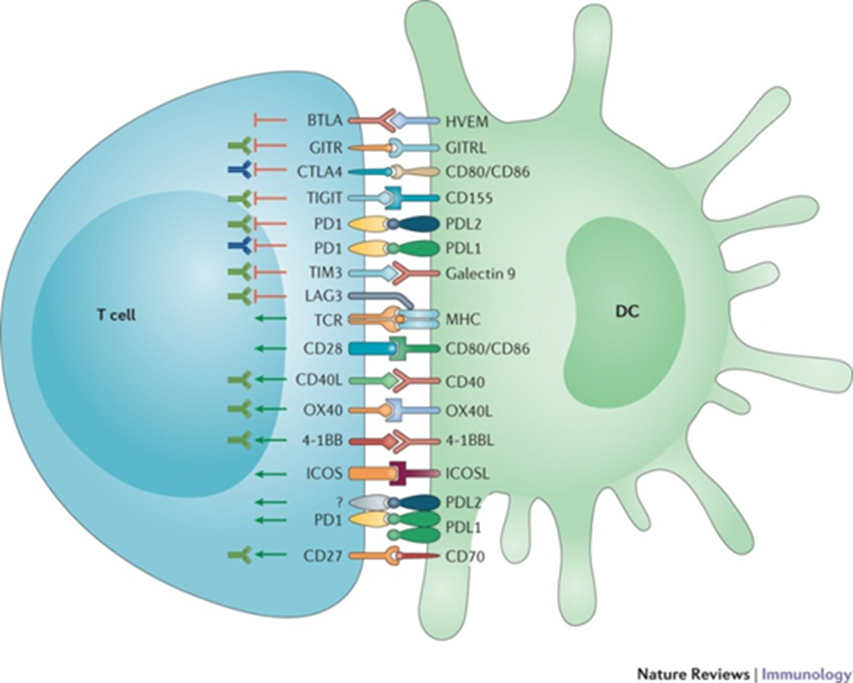
图3 常见免疫检查点(图源:[2])
ICT 的临床进展
免疫检查点药物的研发道路漫长,James P Allison 从萌生 CTLA-4 的抗体药物研发想法开始,到 CTLA-4 抑制抗体最终获得 FDA 批准认证,耗时将近15年。2011年,FDA 批准了第一个 ICIs(靶向CTLA-4的Ipilimumab),用于晚期黑色素瘤的辅助治疗,开启了ICT新时代。
目前,免疫检查点主流靶点还是 PD-1/PD-L1,但是许多其他检测靶点药物已进入临床。FDA 已批准 ICTs 用于 89 项人类癌症适应症,涉及皮肤、泌尿生殖系统、肺、头颈部、乳腺、淋巴瘤、妇科和胃肠道恶性肿瘤等(表1)。最常用的 PD-1/PD-L1 抑制剂有帕博利珠单抗(Pembrolizumab)、纳武利尤单抗(Nivolumab)、阿特珠单抗(Atezolizumab)、德瓦鲁单抗(Durvalumab)、特瑞普利单抗(Toripalimab)、信迪利单抗(Sintilimab)、卡瑞利珠单抗(Camrelizumab)、替雷利珠单抗(Tislelizumab)、派安普利单抗(Penpulimab)。
表1 FDA批准的主要ICTs及适应症

▲数据来源:[1]
由于肿瘤的复杂性及易复发、易转移特性,单一用药往往难以取得理想疗效,联合用药或联合疗法更有效。临床上只有大约 20% 患者对单药治疗有反应,但 anti-CTLA-4 联合 anti-PD-1/L1 在多种肿瘤中显示出更高反应率,甚至可克服特定患者适应性耐药机制,在某些癌症(如黑色素瘤)中显示出改善的总生存期(overall survival,OS);LAG-3 和 PD-1 存在协同作用,联合检查点抑制与单独使用纳武单抗相比,可延长先前未经治疗或不可切除黑色素瘤患者的无进展生存期(Progression-Free Survival,PFS),57% 可切除黑色素瘤患者病理完全缓解;TIGIT 抗体Tiragolumab与Atezolizumab(anti-PD-L1)联合治疗广泛期小细胞肺癌(Small Cell Lung Cancer,SCLC),未能达到 PFS 主要终点。目前,多个临床试验正在测试 anti-TIGIT 的单一疗法和联合疗法。
对于前列腺癌、胰腺癌和胶质母细胞瘤等对 ICT 反应率较低的肿瘤类型,迫切需要新的 ICT。已有多项研究调查了其他抑制检查点分子在改善ICT应答中的作用,包括 TIM-3、VISTA、BTLA、Siglec-15 和共刺激分子如ICOS、CD40、4-1BB 和 OX40等。除了靶向细胞表面分子外,新的细胞内在免疫调节途径,如代谢和表观遗传途径已进入研究阶段,以确定其作为治疗靶点的潜力。
ICT 与传统癌症治疗的联合
1、ICT 联合化疗
ICT 联合化疗的多种组合方案正在进行临床试验。在晚期、复发或转移性食管鳞状细胞癌患者中完成的3期 CheckMate 648 试验结果显示,Nivolumab联合化疗,显著改善了 OS;在可切除非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)患者中进行的CheckMate 816试验结果显示,纳武单抗联合铂类新辅助化疗改善了 24% 患者的无事件生存期和病理完全缓解,而单独化疗组只有 2.2%;此外,卡铂和依托泊苷联合抗 pd-l1(Atezolizumab)将 SCLC 患者中位生存期从安慰剂组的 10.3 个月提高到治疗组的 12.3 个月;最近公布的III期IMvigor130试验(NCT02807636)结果显示,与单独化疗相比,Atezolizumab 联合化疗未能改善 OS。为了更好地将化疗与 ICT 相结合,需要在适合特定肿瘤类型的动物模型或体外实验中,深入研究化疗对免疫系统的影响。
2、ICT 联合放疗
在转移性 NSCLC、转移性头颈部鳞状细胞癌和默克尔细胞癌患者的临床试验中,放疗联合免疫检查点阻断未能显示出临床疗效。然而,在早期 NSCLC 患者中,立体定向放疗与新辅助 Durvalumab 联合使用时,观察到主要的病理反应,这表明放射联合 ICT 可能取决于疾病的分期和免疫检查点阻断的时机。
3、ICT 联合靶向治疗
血管生成抑制剂和 ICT 联合使用的有效性已经在多项临床试验中得到证实。基于 KEYNOTE 426 试验(NCT02853331)和CHECKMATE-9ER试验(NCT03141177)的结果,FDA 批准了 Pembrolizumab 联合阿西替尼、Nivolumab 联合 Cabozantinib 作为晚期肾细胞癌患者一线治疗。Anti-PD-L1 与多种靶向疗法的联合治疗正在进行试验。
4、ICT 联合溶瘤病毒
溶瘤病毒(OV)可以感染和分解癌细胞,既能在癌细胞中自然复制,经改造后又能有选择性地靶向癌细胞。但是迄今为止,只有一种 OV 疗法获得 FDA 批准,即Talimogene Laherparepvec(T-VEC)。最近进行的 MASTERKEY-265 III期研究比较了 T-VEC 与 Pembrolizumab 联用和单药 Pembrolizumab 效果,结果显示客观缓解率有所改善(48.6% vs 41.3%),但未达到 PFS 和 OS 双主要终点。在分析联合治疗虽带来反应但缺乏生存益处的原因时,需要对组织进行更深入的相关分析,评估 OV 的免疫调节影响、慢性干扰素刺激的效果、ICT 的选择以及临床试验设计等多个因素。
5、ICT 联合手术
ICT 联合手术可对完整肿瘤标本进行检查,以确定对治疗的反应和抵抗机制。此外,ICT 在与手术切除肿瘤相关的情况下,治疗的时机可能影响患者的治疗反应和结果。近期,一项针对失配修复缺陷的局部晚期直肠腺癌的临床试验获得了100%的临床缓解率,患者不需放化疗或手术。这个发现提高了 ICT 实现器官保留的可能性,对患者的长期预后和生活质量可能产生重要影响。
ICT 面临的挑战
耐药性、免疫相关不良事件(Immune-related Adverse Events,irAE)和缺乏选择优势患者的预测性生物标志物是ICT面临的三个关键挑战。
1、ICT 耐药性
癌症免疫疗法协会(SITC)在临床实践中提出三种 ICT 耐药性的共识定义:在未作出反应的患者中出现的原发性耐药性、在有一段治疗反应后出现的继发性耐药以及在停药后进展。
ICT 耐药性归因于肿瘤细胞内部因素和肿瘤微环境(Tumor Microenvironment,TME)相关外部因素。内部因素包括由于肿瘤特异性基因改变、染色质重塑和致癌信号传导等导致缺乏免疫原性。肿瘤细胞表面缺少可以供免疫细胞进行识别的新抗原、肿瘤组织中浸润的T细胞数量减少、编码抗原加工或呈递组分的编码基因受损、IFN-γ 信号通路异常、严重的T细胞耗竭、炎症/代谢调节以及其他免疫检查点的作用等;在外部因素中,TME 中的基质细胞、血管系统和细胞外基质,与肿瘤和免疫细胞协同作用,在肿瘤的发展和治疗耐药方面起着关键作用。
2、irAE
不同的 ICT 治疗方案表现出不同的毒性模式,已有数据表明非致命性 irAE 的发生与 ICT 的反应之间呈正相关。irAEs 包括 70 多种不同的病理变化,其严重程度从轻微到致命不等,几乎关联到每个器官。免疫细胞亚群和细胞因子可驱动 ICT 引发结肠炎;循环中的 CD4 记忆细胞可作为预测黑色素瘤中多种 irAEs 指标;自身耐受丧失、分子拟态以及补体介导的炎症与 irAEs 的发展也有关联。
3、生物标志物
与遗传异常(如 EGFR 突变、ALK 易位)通常定义为二进制(是或否)预测靶向药物的疗效不同,ICIs 通常会面临关联等级和连续变量问题,如 PD-L1 表达、TMB 和肿瘤来源的 IFNγ 基因特征,而且在不同的适应证中,可以具有多个不同的生物标志截点值。此外,传统的肿瘤内在因素,或单一免疫特异性标志物仍然不够精确,ICT 需要同时关注宿主和肿瘤免疫生态系统的特征,选择组合生物标志策略。
解决当前 ICT 挑战的方法
除了免疫系统外,宿主自身的其他因素,如微生物组、神经信号和激素信号,对 ICT 的效果产生了重要影响。这些因素的了解可以帮助我们更好地优化和个体化免疫细胞治疗策略。
1、微生物组
在实验动物模型中发现,ICT 反应可能与肠道中特定种类的共生细菌有关。在癌症患者中,特定微生物种类会影响淋巴结或 TME 中免疫细胞的功能和成熟,从而调节对 ICT 反应。但是,微生物组虽与 ICT 反应相关,却没有共同生物标志物。因此,研究人员需要进一步探索微生物组对 ICT 反应的细节。
2、神经信号
神经是肿瘤形成的主要驱动者,通过调控干细胞、驱动血管生成、调节免疫系统和影响微生物群启动肿瘤发生,而在肿瘤发生的早期阶段又通过神经浸润促进肿瘤生长,最终形成肿瘤。神经免疫轴是 TME 的重要参与者,可以直接加速癌细胞增殖、生存、侵袭和远处转移,并影响 ICT 效果。在未来的研究中,研究人员需要考虑神经信号对 ICT 反应的影响。
3、激素信号
临床前研究中雄激素受体抑制对免疫系统有一定影响,但将其与 ICT 结合时并未显示出明显的临床益处。这可能是因为 TME 对治疗的反应是动态的,而且存在多种不同类型的细胞在其中表达了雄激素受体。因此,研究人员需要探究激素治疗的细胞和分子机制,探索与 ICT 联合策略,提升治疗效果。
4、样本的纵向分析
肿瘤在时间和空间上的演化导致了肿瘤内部的异质性,这对于治疗抵抗和疾病进展起着重要作用,包括对 ICT 的反应。在 TME 异质性和患者基因多样性的背景下,单一时间点的组织活检样本难以全面描绘动态的肿瘤-免疫微环境相互作用。长期的组织样本采集可以为了解肿瘤演化提供重要的信息,从而更好地理解 ICT 反应和抵抗的机制。
5、逆向转化研究
为了开发联合治疗方案,需要了解每种药物的作用机制和对特定肿瘤免疫反应的影响。逆向转化研究涉及从临床观察出发,选择某种治疗方法或药物,并在小规模的患者队列中进行研究,收集并彻底分析纵向样本,提出有关免疫机制的假设,在适当的临床前模型中进行测试。逆向转化研究还可以揭示药物的潜在不足之处,帮助预测患者对治疗的反应,并指导下一步的临床试验设计,避免失败。通过将临床结果与实验室研究相结合,深入探究单个药物或治疗的效应及其对免疫反应的影响,逆向转化研究为个体化的癌症治疗策略的制定提供了有力的支持。
6、结合高通量技术和计算生物学
为了最大化 ICT 效益,可利用高通量技术和计算生物学方法。从临床观察出发,研究单个药物或治疗的机制及其在特定肿瘤中的免疫反应影响。通过全基因组测序和全外显子测序,测定与免疫治疗反应相关的肿瘤突变负荷和新抗原负荷。此外,单细胞技术如单细胞 RNA 测序、转录组和表位的细胞标签测序、单细胞染色质可及性测序技术等,可以揭示免疫细胞群体和细胞状态的细节。空间转录组学方法如 CODEX、DSP、Visium 等,可以研究肿瘤内细胞类型及其相互作用。同时,将机器学习和先进的人工智能模型引入免疫治疗研究中,有助于更精确地预测患者对治疗的反应。此外,结合转录组、表观基因组和基因组数据的计算方法,可以鉴定出免疫治疗反应和耐药的生物标志物,促进逆转译研究。高通量技术和计算生物学通过整合不同类型的数据和计算方法,可深入了解 ICT 治疗机制、发现生物标志物、优化治疗方案,有助于了解免疫治疗对肿瘤微环境和免疫反应的影响。
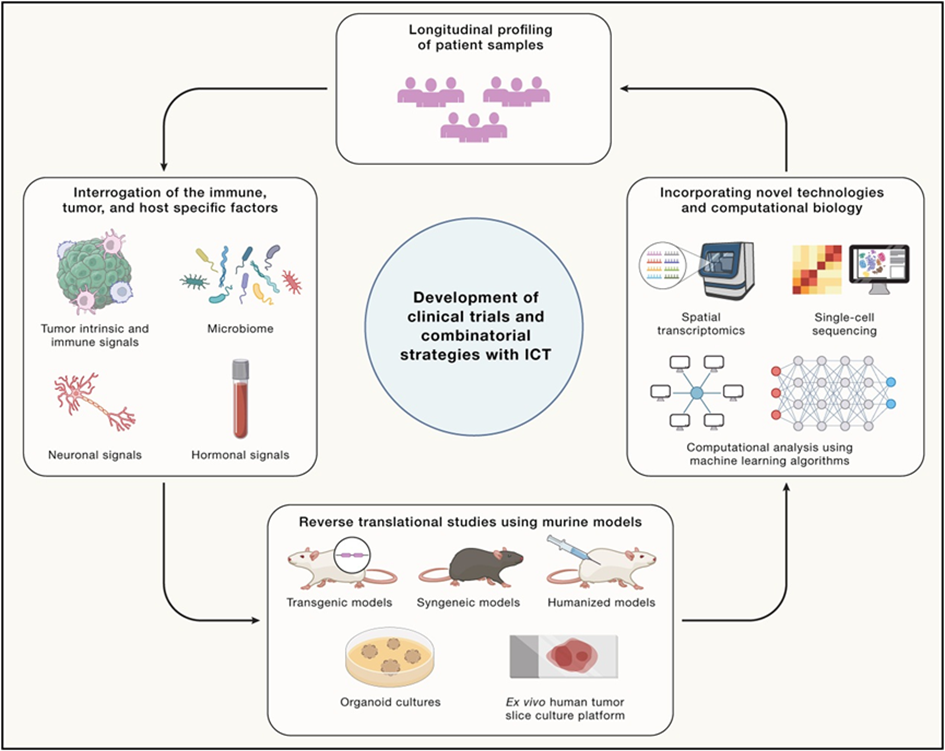
图4 解决当前 ICT 挑战的精准方法(图源:[1])
对T细胞功能机制的深入了解,推动了 ICT 的发展,也为不同肿瘤类型的患者提供了临床益处。为了实现 ICT 对癌症的治愈,我们需要采用逆向转化策略将临床研究与发现科学相结合,重点分析治疗前后纵向患者样本,探索特定机制。在更早期疾病情况下的应用 ICT,有助于降低疾病分期,甚至保留患者的器官。ICT 的临床成功凸显了开发以生物学为基础的治疗策略和以改善患者临床结果的重要性。
参考资料:
[1]Sharma P, Goswami S, Raychaudhuri D, et al. Immune checkpoint therapy-current perspectives and future directions. Cell. 2023 Apr 13;186(8):1652-1669. doi: 10.1016/j.cell.2023.03.006. PMID: 37059068.
[2]Wykes MN, Lewin SR. Immune checkpoint blockade in infectious diseases. Nat Rev Immunol. 2018 Feb;18(2):91-104. doi: 10.1038/nri.2017.112. Epub 2017 Oct 9. PMID: 28990586; PMCID: PMC5991909.
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。