泰格洞见
2023数字化/去中心化临床试验行业发展现状调研分析报告
2024年01月03日
2024年1月3日,泰格医药正式发布《2023数字化/去中心化临床试验行业发展现状调研分析报告》。
本次调研是中国药品监督管理研究会受国家药监局药品注册司委托的《国内外药品研制环节有关管理法规与技术指南体系研究》的一个子课题,由泰格医药牵头,北京清华长庚医院、北京大学第一医院、北京佑安医院、赛纽仕、富启睿、思路迪,以及相关监管部门、科研院所、患者组织等共同参与。

本次调研于2023年5月启动,12月底完成报告。数据来自于制药企业、大学和研究机构、医院、CRO/SMO、技术服务商等近 900 份有效问卷;调研对象覆盖临床运营、医学监查、医学科学、IT、数据统计、药物警戒、财务和采购等十余个职能。
本报告正是基于此次调研的信息,从业界实践、技术平台、法规考量等方面对数字化/去中心化临床试验(DCT)在中国的现状、面临的挑战及行业各方的期望进行了总结分析,旨在通过临床试验各参与方的真实声音,探讨DCT在中国的监管政策和基础设施,为未来发展提供重要参考,为数字化临床试验行业提供能量与活力。
调研显示,2013年至今的期间里,只有 28.8% 的受访者在临床试验中使用过DCT相关的数字化/去中心化技术或模式。DCT在中国仍处于发展初期并需要持续的推广和普及。相对于研究机构和申办方,CRO在该方面走在前端,使用率超过 52%。
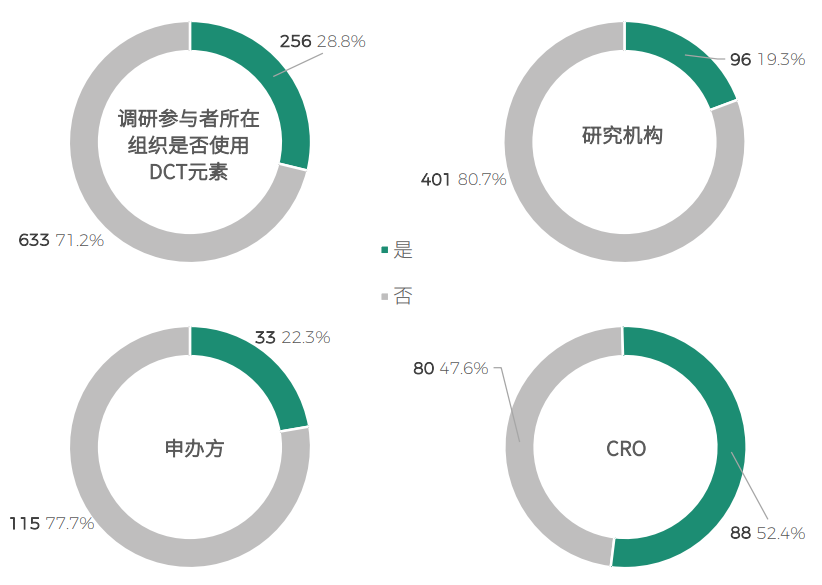
Q:您的组织是否在临床试验中使用了DCT相关的数字化/去中心化技术或模式?(2013年至今)
技术方面,24.9% 的受访者认为目前可用的临床技术解决方案能够满足执行DCT的需求,19.7% 的受访者认为不满足,而表示不确定是否满足的占比接近50%。
除了智能化平台的技术因素以及沟通协调的组织因素外,这也反应了由于缺少足够的实践积累,各参与方不确定是否能够有效地实施和管理这些技术、如何确保数据安全和隐私、是否能获得足够的技术支持,以应对可能出现的问题。
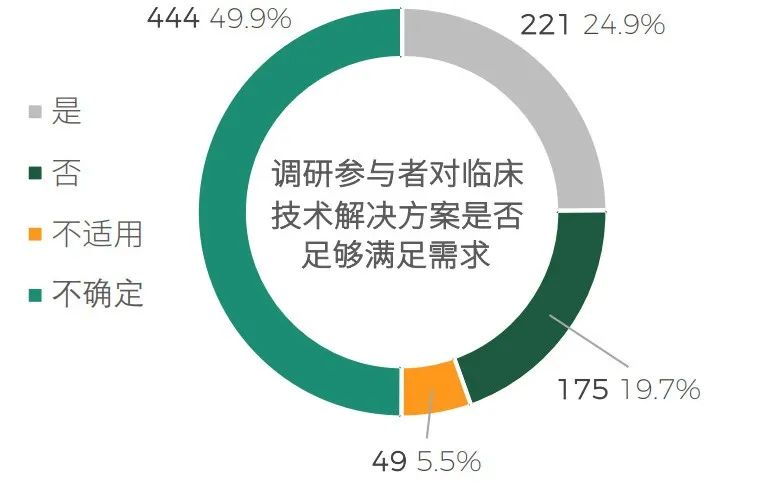
Q: 总体来说,您是否认为目前可用的临床技术解决方案足以满足您成功执行DCT?
法规方面,表示现有法规暂不能满足DCT实施的受访者占比近 40%。与之相比,只有 15.9% 的人选择“是”,而有 44.2% 的人表示“不确定”。从结论来看,DCT在中国的普及和实施需要更多政策指引和法规明确性,并确保与DCT的最佳实践相一致。此外,提供更多的培训和指导也有助于更好地理解法规和促进实施。
Q: 您认为中国现有的临床试验相关法规是否能满足DCT各环节实施细节的指导?
更多详细内容,请点击“阅读原文”下载完整《2023数字化/去中心化临床试验行业发展现状调研分析报告》。
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。