泰格洞见
DCT助力罕见病临床试验,这些挑战值得关注
2024年07月19日
在数字化、智能化技术愈发成熟的当下,临床试验的模式也正在发生改变,去中心化临床试验(DCT)成为行业大势所趋。尤其是在罕见病这个特殊的领域,如何利用新技术和新模式推动罕见病药物的临床开发,成为了业界关注的课题。
DCT模式如何助力罕见病药物临床试验,实际案例可以为我们带来哪些经验?近日,泰格云课堂邀请到了临床研究者、临床运营、政策法规和数字化技术方面的专家,分享了相关洞见。
泰格医药医学事务副总监张芸对CDE近期发布的《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》进行了深入解读。由于罕见病患者往往数量较少,症状较重,增加了相关临床试验的招募和管理难度。在罕见病DCT中,应当遵循“以患者为中心”、“切合目的”、“基于风险的质量管理”等原则,利用受试者远程招募、电子知情同意、远程访视与评估、医患交流互动/患者教育、受试者的安全性监测、试验药物的直达和回收等DCT的方式和手段,让罕见病患者更便利地参与临床试验。同时在罕见病临床试验中,应当注意明确 DCT 各方职责及沟通渠道,制定有效的风险控制计划,还应当重点关注合规性与数据安全、数据质量,并加强与监管机构的沟通交流。

泰格医药合规与培训总监辛欣分享了罕见病临床试验运营方面的实操经验。她介绍,罕见病研究在受试者招募、依从性管理、研究数据获得的完整性方面,都有非常大的挑战,电子知情,DTP,eCOA,home visit等DCT元素的应用,可以提高参加研究的便利性,提高效率和质量。申办方在实施DCT时,应当关注供应商的管理、流程的合规,以及风险评估和培训。泰格医药有着丰富的罕见病临床试验项目经验,也有部分项目在实施过程中采用了DCT的元素,比如ePRO等。她还用具体案例,介绍了泰格医药DCT解决方案在提升临床试验质量和效率方面的实践。
北京协和医院药理研究中心主任韩晓红教授探讨了罕见病药物临床试验中DCT模式的探索与实践。分享了北京协和医院将临床试验DCT模式和元素嵌入互联网医院智能化医疗平台的方案,减轻受试者负担,提高临床试验效率;强调临床试验中应用DCT模式,应当严格依法合规,以患者需求为导向,细化方案和操作规程,同时关注安全性风险和数据质量、数据安全。
在讨论环节,泰格医药E-site大区总监丁月琴作为主持人,与韩晓红教授、辛欣女士、张芸女士以及泰格医药IT合规总监刘华清等共同就DCT目前在行业的接受度、供应商的选择、执行的难点等话题进行了探讨。专家普遍认为,临床试验的参与各方都对DCT的应用十分期待,行业认可度也越来越高,同时也应当关注DCT应用过程中,必须坚持以患者为中心,确保数据质量和患者权益,相关的指导原则也给行业指明了发展方向和操作指引。
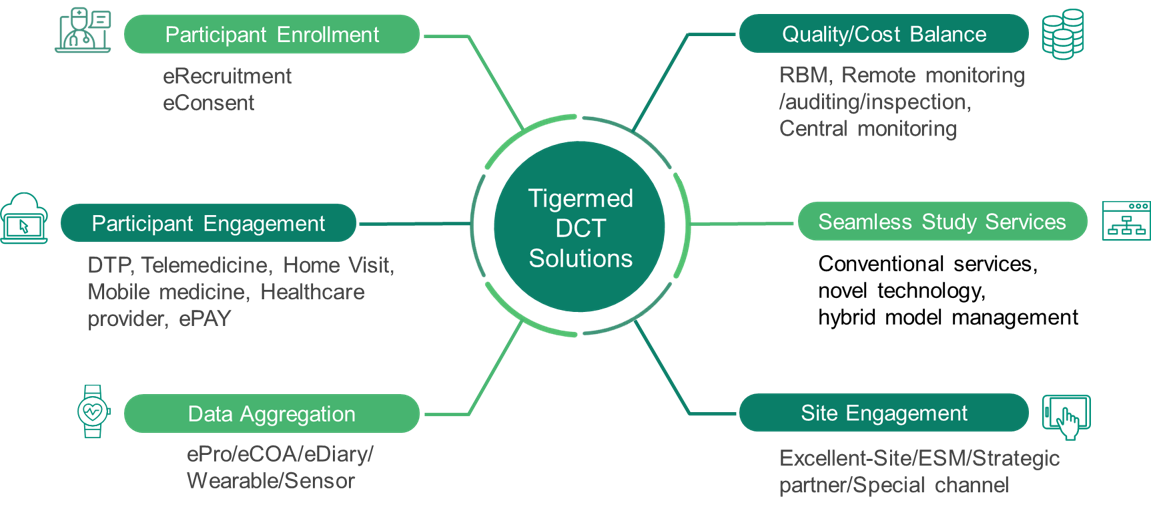
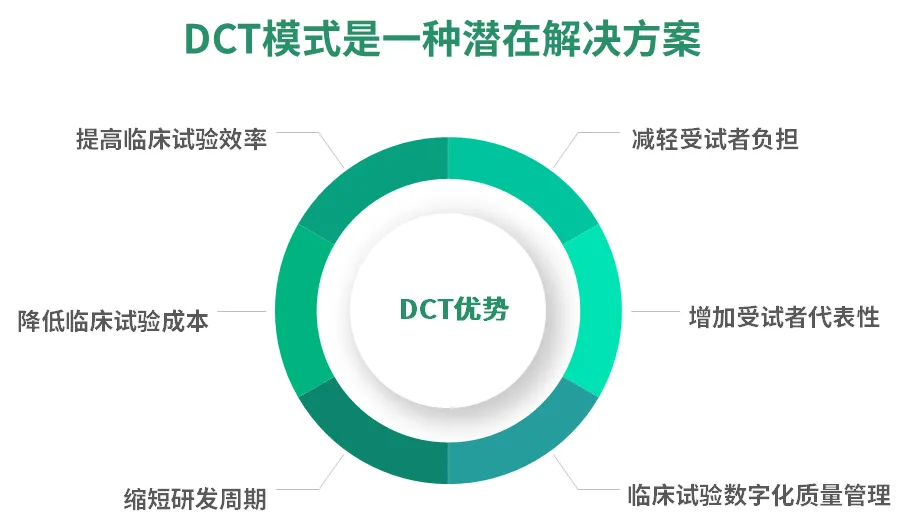
随着DCT模式在临床研究领域更深和更广地应用,行业也愈发关注实操过程中的问题,包括合法合规、数据质量、患者权益等。泰格医药DCT解决方案有着丰富的项目经验,运用DCT元素和模式,加速新药研发效率,提升研发质量。未来,我们也将持续完善服务能力,探索更多创新的临床试验模式与解决方案,助力创新药研发,造福全球病患。
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。