
临床开发
国际多中心临床研究(MRCT)
覆盖五大洲的全球运营团队和当地临床资源,加速推进您的全球产品开发。
国际化的赋能平台
随着医药创新趋于全球化,国际多中心临床试验 (Multi-regional Clinical Trial,MRCT) 已得到全球制药和医疗器械行业的广泛认可,并成为新产品注册临床试验数据的主要来源,用于多国的上市申请。泰格医药通过覆盖北美、南美、欧洲、非洲、亚太的数十个分支机构和1,000多名海外临床专业人员,实现了“服务全球化+人才本地化”的模式,打造了全球同步的赋能平台,快速启动并推进您的国际项目。
2021年2月,泰格医药作为牵头临床CRO与康希诺生物及巴基斯坦当地的专家,以及墨西哥、俄罗斯、智利和阿根廷的临床专家合作,成功完成了首个由中国申办方启动,临床中心包含亚洲、欧洲和拉美等多个地区的全球多中心新冠疫苗三期临床研究。
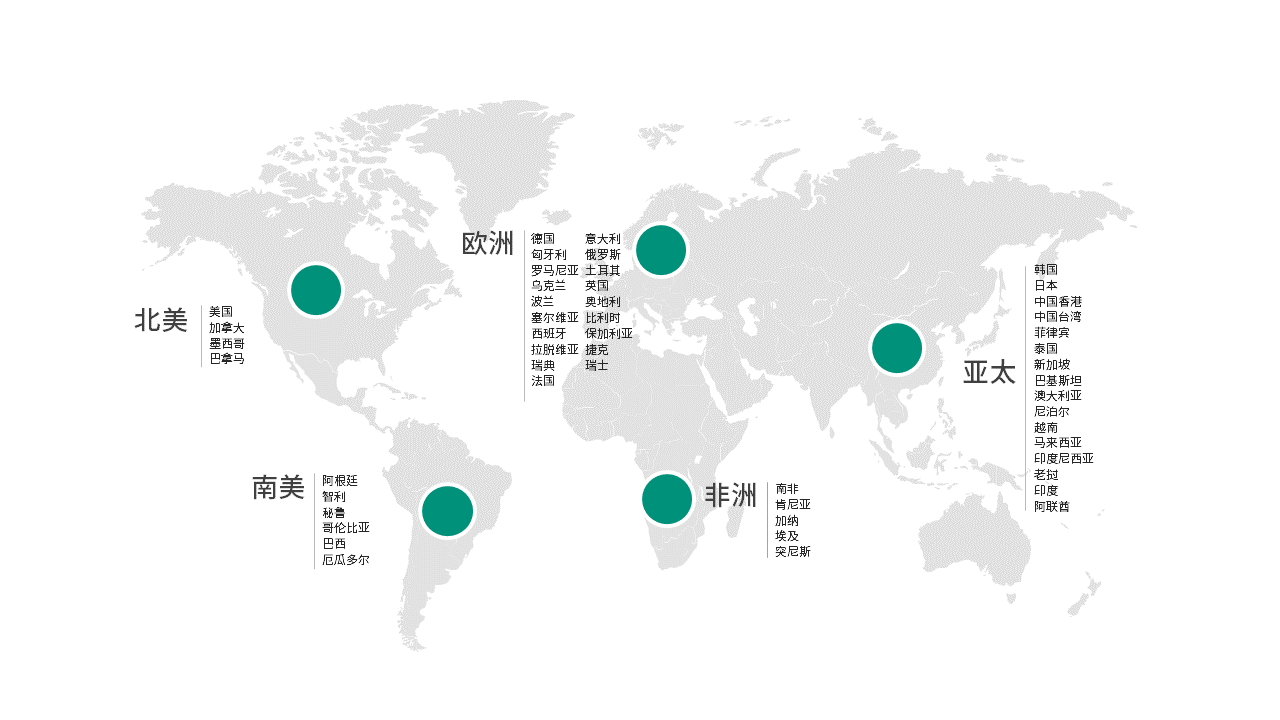
在50个国家和地区支持客户的国际研发项目
在30个国家和地区支持客户的国际研发项目
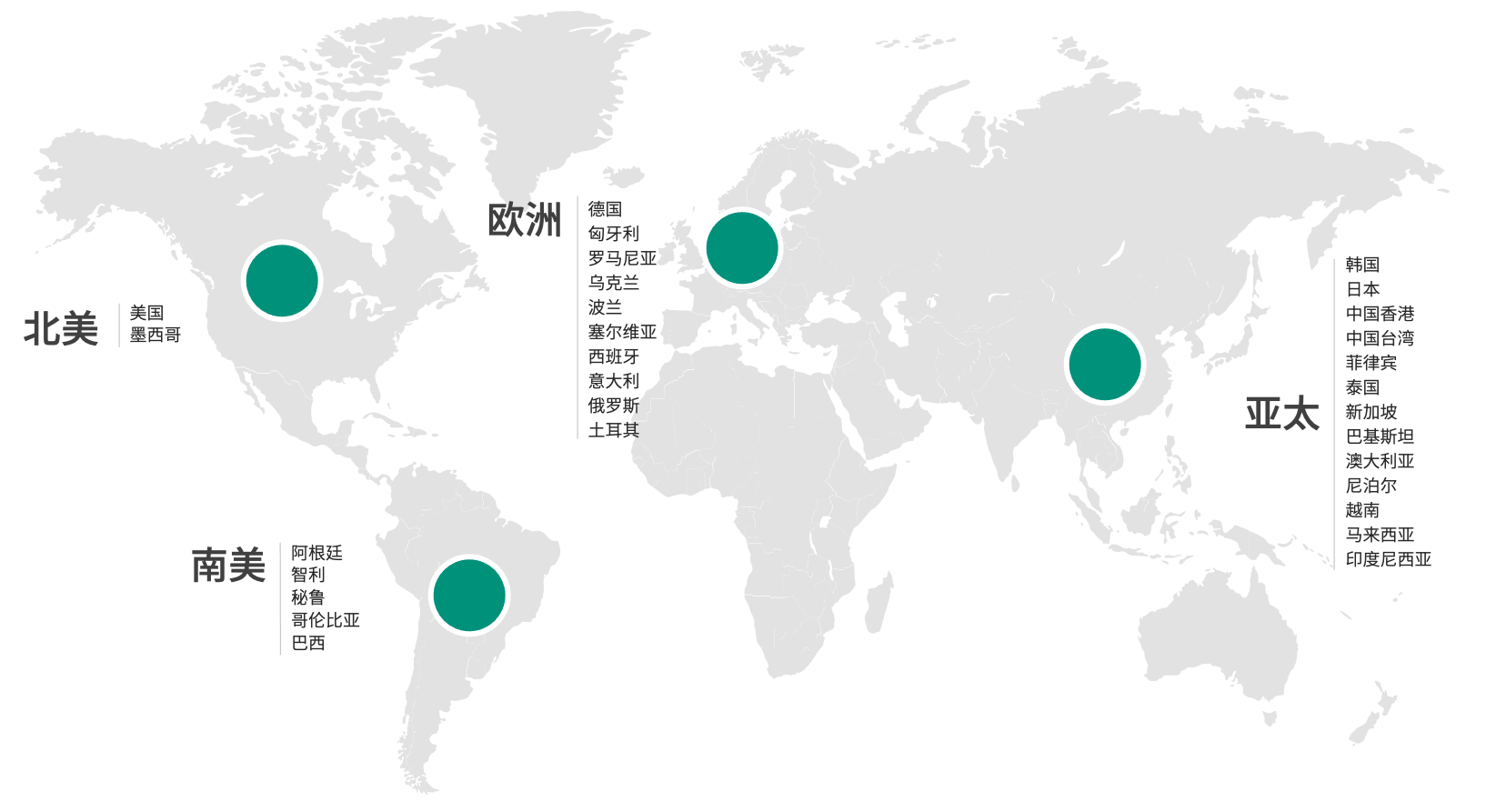
北美
美国
墨西哥
南美
阿根廷
智利
秘鲁
哥伦比亚
巴西
欧洲
德国
匈牙利
罗马尼亚
乌克兰
波兰
塞尔维亚
西班牙
意大利
俄罗斯
土耳其
亚太
韩国
日本
中国香港
中国台湾
菲律宾
泰国
新加坡
巴基斯坦
澳大利亚
尼泊尔
越南
马来西亚
印度尼西亚
全球化项目管理团队
经验丰富的全球项目管理团队(Global Project Management, GPM),具备良好的跨部门、跨区域、跨职能的协调能力;
作为申办方第一联络人,与申办方确认工时、工作范围和参与方;
制定临床试验时间表、准备试验文件、组织团队并启动定期例会;
GPM团队作为申办方、临床监察、研究中心、质量控制、供应商、技术支持等各方的纽带,在项目全周期中提供

本地化的临床运营团队
临床运营团队覆盖世界五大洲,配备充足且经验丰富的当地PD/PM/CRA,并熟悉当地的临床政策和注册法规
内部专家与外部合作伙伴相结合,搭建全球服务网络;为全球监管路径和临床开发计划提供充分的早期咨询服务
在非洲、中东、亚太的30多个国家拥有战略合作CRO,快速协调各国资源
领先的跨国一体化服务能力
全球一体化的SOP流程、全球一体化的预算管理,遵守 ICH-GCP、本地GCP及所有其他适用法规
拥有丰富NMPA、FDA、EMA经验的法规注册专家,提供符合多国申报要求的开发策略
在中国建立了集成化的上下游服务中心,涵盖医学撰写、注册、数统、药物警戒、中心实验室、中心影像等
团队中具有大量国际项目经验人才,并针对国际化制定了专门的人才储备及发展计划
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。