泰格洞见
更年期潮热非激素药物疗法的研发成败案例分析
2024年09月03日
引言:非激素药物在更年期潮热治疗的研发中面临诸多挑战,包括药物安全性特征与在精神科疾病患者不同、药物疗效偏弱、临床前药效模型与临床症状缓解的关联度弱,以及剂量探索试验需要较大样本量等。
近日,泰格医药首席医学官陈霞博士作为通信作者,与中国药科大学基础医学与临床药学学院相羽曦在《中国临床药理学杂志》上发表文章《更年期潮热非激素药物疗法的研发成败案例分析》,深入分析了去甲文拉法辛缓释片、艾司米氮平片和甲磺酸帕罗西汀胶囊3种非激素药物治疗更年期潮热的临床研发历程,为后续类似适应证的药物研发提供了优化试验设计、降低研发风险的策略借鉴。
以下为文章正文内容:

潮热出汗是更年期综合征的特征性表现,对女性的生活质量、睡眠和工作效率均有负面影响[1]。绝经后激素治疗能有效减轻或消除潮热,改善患者的睡眠质量、情绪和记忆力,已被多个诊疗指南列为更年期潮热的标准治疗。但是,激素治疗也存在增加乳腺疾病、心血管疾病和血栓栓塞等风险,因此临床上还需要安全有效的非激素药物提供更多治疗选择[2-3]。本文以甲磺酸帕罗西汀胶囊(商品名:Brisdelle)和2个机制相同但研发失败的药物去甲文拉法辛缓释片(商品名:Pristiq)、艾司米氮平片的临床试验为案例,进行对比和分析。
1 非激素药物治疗更年期潮热症状的临床试验概况
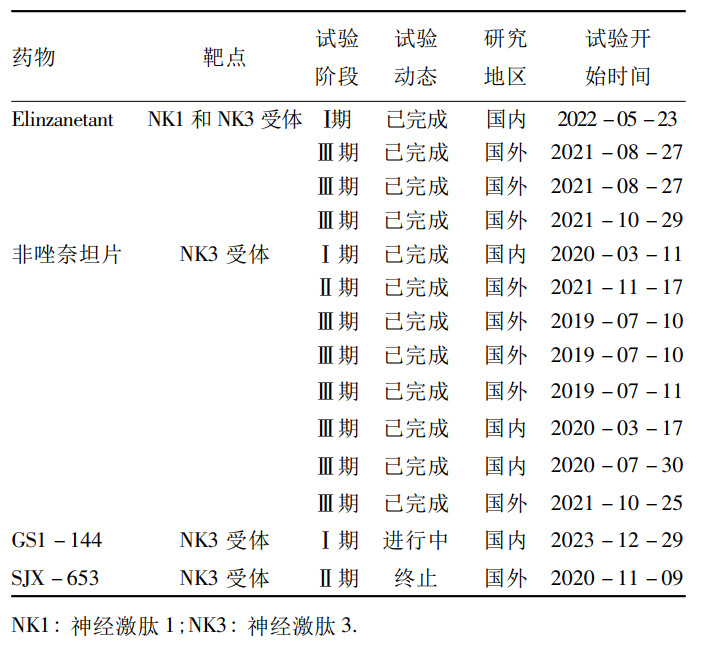
在药物临床试验登记与信息公示平台和ClinicalTrials.gov网站上分别以“潮热”“hot flashes”为关键词,检索2019年1月至2024年1月开展的非激素药物治疗更年期潮热症状的临床试验,共检索到14项试验,涉及4种非激素药物,其作用靶点均为神经激肽(Neurokinin,NK)受体(见表1)。其中,有9项试验在国外开展、5项在国内开展;12项试验已完成、1项正在进行、1项因未达到预期结果而终止。目前,美国食品药品监督管理总局(U.S. Food and Drug Administration,FDA)只批准了2种非激素药物用于治疗更年期潮热症状,分别是选择性5-羟色胺和去甲肾上腺素再摄取抑制药(Serotonin and norepinephrine reuptake inhibitors,SNRIs)甲磺酸帕罗西汀胶囊和NK3受体拮抗药非唑奈坦片(商品名:Veozah)。
表1 近5年国内外非激素药物治疗更年期妇女潮热的临床试验开展情况
2 FDA指导原则对治疗更年期潮热药物的临床研发建议
FDA发布的《绝经后妇女激素含雌激素/黄体酮联合药物替代治疗的临床评价指导原则》(2003年)为治疗更年期潮热的激素类药物的临床研发提供了建议[4]。指导原则建议药企开展一项或多项为期12周的随机、双盲、安慰剂对照Ⅲ期临床试验来验证研究药物对更年期潮热的疗效。如果研究药物是新型分子实体或预估易出现新的安全性问题,则需进行2项确证性Ⅲ期试验。试验的目标人群为有中重度潮热症状的绝经后妇女。潮热程度在临床上可划分为轻度(有热感但不出汗)、中度(有热感并出汗,能继续活动)和重度(有热感并出汗,导致活动停止)。中重度潮热症状要求基线时每天至少有7~8次或每周至少有50~60次中、重度潮热发作。指导原则推荐以下4个指标作为III期试验的联合主要终点,即第4周和第12周日平均中重度潮热频率较基线的变化,以及第4周和第12周平均潮热程度较基线的变化。值得注意的是,FDA的指导原则中并未就平均潮热程度的计算方法提供明确建议。下文所列的III期试验中,如未专门指出,试验设计均遵循FDA指导原则要求。
3 3种非激素药物治疗更年期潮热的临床研发历程
3.1 去甲文拉法辛缓释片
去甲文拉法辛缓释片是文拉法辛主要活性代谢物去甲文拉法辛的琥珀酸盐,是一种SNRIs,可以通过选择性调节下丘脑的5-羟色胺和去甲肾上腺素水平,降低下丘脑神经调节核的温度调节设定点,治疗潮热症状[5]。在临床前研究中,去甲文拉法辛可在2种不同的去卵巢大鼠血管舒缩症状模型中恢复动物的体温调节能力[6]。
去甲文拉法辛缓释片没有公开发表的II期试验信息,但做了5项针对更年期潮热的Ⅲ期试验。
第1项Ⅲ期试验[7]纳入了707例目标患者,按2∶2∶2∶2∶1比例随机分配至50 mg qd组、100 mg qd组、150 mg qd组、200 mg qd组和安慰剂组,治疗期52周。去甲文拉法辛缓释片治疗抑郁症、纤维肌痛症、糖尿病周围神经痛的推荐剂量为50~200 mg,另外多个适应证的试验都发现,400 mg剂量的耐受性较差,因此本试验设置的最高剂量为200 mg qd。试验结果显示:50 mg组的4个终点指标均与安慰剂组无显著差异;100 mg组到200 mg组在4个指标中均有1~3个指标与安慰剂组的差异未达到显著,100、150、200 mg的3个剂量组间未见明显的剂量效应关系。另一方面,试验中的不良事件(Adverse Events,AE)发生率却随剂量增加,发生率高于安慰剂组的AE包括恶心、头晕、失眠、嗜睡、口干等。各剂量组因AE而停药的比率均显著高于安慰剂组(50 mg:18.12% vs 15.58%,PPPP
第2项Ⅲ期试验[8]共纳入567例患者,1∶1∶1随机至100 mg qd组、150 mg qd组和安慰剂组,治疗期26周。试验结果显示,100 mg组和150 mg组的所有主要终点指标均与安慰剂组有显著差异(100 mg组:12周潮热频率变化:-6.30 vs -4.90,PPPP[9],根据试验结果选择适当的剂量滴定方案改善去甲文拉法辛缓释片给药初期的耐受性,同时设置停药时逐渐减量以减轻停药症状。
确定滴定方案后的第3项Ⅲ期试验[10]纳入了458例患者,疗程12周,其中第1周设置为剂量滴定期,在完成12周给药后再设置2周剂量递减期。试验结果显示,100 mg组和150 mg组的所有疗效终点均与安慰剂组有显著差异(100 mg组:12周潮热频率变化:-7.10 vs -5.80,PPPP
第4项Ⅲ期试验[11]与前3项不同,其研究地区从美洲变为欧洲,共纳入485例患者,按1∶1∶1比例随机分配到100 mg qd组、阳性对照替勃龙2.5 mg qd组和安慰剂组,治疗12周。试验结果显示,100 mg qd组的4项疗效指标均与安慰剂组无显著差异,而替勃龙组的疗效指标却都显著优于安慰剂组(4周潮热频率变化:-6.16 vs -4.38,PPPP10%,这些AE的发生率都高于安慰剂组和阳性对照组。该试验中,试验组的AE停药率高于安慰剂组和替勃龙组,而试验组因疗效不佳退出的比例也比替勃龙组高。申办方认为,不同种族女性的药代动力学差异可解释该试验结果与先前试验结果的不一致,受试者在知情同意时被告知试验中有阳性对照药物也有可能导致该试验的安慰剂效应增加。尽管如此,该试验中阳性对照组的疗效结果也提示去甲文拉法辛缓释片本身的疗效不足才是试验失败的根本原因。
第5项Ⅲ期试验[12]回到美国和加拿大开展,纳入390例患者,1∶1随机至100 mg qd组和安慰剂组,疗程12周,各试验组的样本量约为200例,比前4项试验的单组样本量(约150例)略多。试验结果显示,100 mg组的4个主要终点指标均与安慰剂组有显著差异(4周潮热频率变化:-6.50 vs -3.60,PPPPPP
尽管5项III期试验中有3项都获得了阳性疗效结果,欧洲药品管理局(European Medicines Agency,EMA)和FDA仍以疗效欠佳和存在安全性问题为由未批准去甲文拉法辛缓释片用于治疗更年期潮热[13]:在多项III期试验中,本品对潮热频率和潮热程度的降低效应在数值上都不大,实际效应虽然统计学差异显著,却未必具有临床意义;②在第4项试验中,本品的疗效不如阳性对照替勃龙;③本品的安全性问题始终较突出,恶心、头晕等AE发生率较高,各项试验中,患者因AE停药的比例均高于安慰剂组,即使后续试验引入了剂量滴定方案,也仍然存在耐受性欠佳问题。值得注意的是,横向比较发现,本品100 mg qd在更年期潮热患者中的AE发生率分别是:恶心(45.05%~16.50%)、口干(21.29%~8.26%)、头晕(19.35%~9.42%);远高于本品400 mg qd在重度抑郁症试验中报告的AE发生率(恶心12.93%、口干7.89%、头晕5.05%),说明同一给药剂量在不同患者群体中的AE发生率和耐受性也可能不同。
3.2 艾司米氮平片
米氮平也是SNRI类。一项初步探索米氮平治疗更年期潮热症状的单臂研究显示,16例完成试验的受试者在接受4周(1周7.5 mg、1周15 mg、1周30 mg以及1周自行选择15 mg或30 mg)米氮平治疗后,每日潮热频率和每周潮热评分较基线相比分别减少了52.50%和59.50%[14]。
米氮平的S-对映体(艾司米氮平)比R-对映体对5-HT受体的选择性和亲和力更高。申办方针对艾司米氮平片开展了P012和P013试验[15]。P012试验共纳入941例患者,1∶1∶1∶1∶2随机分配至2.25 mg qd组、4.5 mg qd组、9 mg qd组、18 mg qd组和安慰剂组,疗程12周。P013试验共纳入945例患者,试验设计与P012完全一致,各试验组的单组样本量也都在150~200例。2项试验的结果基本一致,仅在P013试验中观察到18 mg组的4个主要终点指标均与安慰剂组有显著差异(4周潮热频率变化:-5.55 vs -3.83,PPPP
基于2项Ⅲ期试验的结果,申办方终止了艾司米氮平片在更年期潮热的研发。此药研发失败主要在于前期研究不充分,在未开展随机、安慰剂对照、足疗程、相同终点指标II期探索性试验的情况下,直接开展2项设计相同的Ⅲ期试验,获得了几乎相同的不利临床结果,欲速却未达。
3.3 甲磺酸帕罗西汀胶囊
帕罗西汀也是SNRIs类药物。申办方先开展了2项随机对照试验[16],探索帕罗西汀控释剂的剂量(12.5 mg qd、25 mg qd vs 安慰剂)。2项试验分别纳入了171例和64例潮热患者,均设置了1周的安慰剂单盲导入期,结果分别有6例(3.51%)和8例(12.50%)患者在导入期后被排除。试验一发现12.5 mg组和25 mg组的6周潮热评分变化均与安慰剂组有显著差异(-8.52 vs -3.82,P<0.05;-7.43 vs -3.82,P<0.05),试验二发现25 mg qd帕罗西汀较安慰剂组显著减少6周潮热频率(-6.10 vs -2.80,P<0.05)。25 mg的帕罗西汀控释制剂与12.5 mg剂量相比并未展现出更好的疗效,且AE发生率更高,因此,申办方研发出了与12.5 mg帕罗西汀控释制剂药代暴露相近的7.5 mg甲磺酸帕罗西汀胶囊用于治疗女性更年期潮热[17]。
随后申办方用甲磺酸帕罗西汀胶囊开展了一项102例潮热患者的Ⅱ期试验,患者1∶1随机至7.5 mg qd组和安慰剂组,治疗8周[18]。结果试验组仅4周潮热频率和8周潮热程度与安慰剂组有显著差异(4周潮热频率变化:-5.33 vs -4.07,PP
在此基础上,申办方开展了2项Ⅲ期试验[N30-004(n=614)]和[N30-003(n=570)][19],考察甲磺酸帕罗西汀胶囊7.5 mg qd相对于安慰剂的疗效和安全性,随机比例均为1∶1,2项试验均设置了1周安慰剂单盲导入期,疗程分别为12周和24周。N30-003试验中,试验组除12周潮热程度外的3个指标均与安慰剂组有显著差异(4周潮热频率变化:-4.71 vs -3.36,PPPP>0.05)。N30-004试验中,试验组的4个疗效指标均达到显著差异(4周潮热频率变化:-4.13 vs -2.71,PPPP
与去甲文拉法辛缓释片和艾司米氮平片的Ⅲ期试验相比,甲磺酸帕罗西汀胶囊III期试验设计的突出特点包括(见表2):①随机前设置1-2周的安慰剂单盲导入期,排除安慰剂效应大的患者;2项试验中安慰剂组12周潮热频率的降幅分别为45.58%和36.15%,总体上低于去甲文拉法辛缓释片和艾司米氮平片试验中安慰剂组的潮热频率降幅(范围34.38%~61.67%,7项试验平均46.59%);②试验的单组样本量约为300例,明显多于前2个药物III期试验中的单组样本量(每组150~200例);预先设置针对潮热程度进行2项试验的荟萃分析,这样在仅有一项试验各终点指标都达到统计显著差异的情况下,最终2项试验的荟萃分析也支持甲磺酸帕罗西汀胶囊对潮热程度的疗效。基于这2项试验,FDA最终批准甲磺酸帕罗西汀胶囊用于治疗更年期潮热[20]。
表2 去甲文拉法辛缓释片、艾司米氮平片和甲磺酸帕罗西汀胶囊的III期试验设计特点对比

4 讨论
基于本文对上述3种药物的分析可知,用于更年期潮热适应症研发的SNRIs类药物的关联药物都曾获批用于焦虑抑郁等精神科疾病,但是药物在拓展新适应证的临床研究过程中,都会因为适应症、药物及其临床疗效的评估特点而遇到一定的困难,存在较大的失败风险。主要体现在:①药物在潮热适应证人群中的安全性特征不同于焦虑抑郁患者,即使很低剂量也有较明显的副作xxa用,导致较高的停药率,显著影响用药依从性;药物对潮热的疗效偏弱,潮热频率相对于安慰剂组的降幅整体较小,潮热程度降幅各试验均较小,但这可能与平均潮热程度计算方法相关:日平均潮热严重程度=(轻度次数×1+中度次数×2+重度次数×3)/轻、中、重度次数之和或日平均潮热严重程度=(中度次数×2+重度次数×3)/中、重度次数之和,当轻度、中度、重度潮热的次数等比例下降时,此两种计算方法得出的结果均呈现潮热严重程度与先前一致,但实际上潮热严重程度确有下降;③临床前药效模型(考察卵巢切除的大鼠模型尾部温度是否在给药后改变)与药物治疗潮热症状的关联度较弱,动物模型有效未必能转化为临床症状缓解;指导原则推荐该适应症的主要疗效终点指标为主观评估,用受试者日志记录获得,安慰剂效应较大;药物在更年期潮热中的剂量需要重新探索,同时由于主观评估指标的安慰剂效应和个体内个体间变异均较大,实际观察到的疗效差异较小,这导致剂量探索试验也需要相对较大的单组样本量,才能获得相对可靠的疗效结果。
从药物临床研发风险预估和风险管理角度,本文分析的案例给我们带来了以下思考。第1,在同机制药物已有失败先例的情况下,新药的开发必须采取更为谨慎的策略,需设法避免“前辈药”已经遇到的问题。如甲磺酸帕罗西汀胶囊通过设置安慰剂单盲导入期预先剔除有较高安慰剂效应的患者,针对不易显效的潮热程度指标预先规定要通过多项试验的荟萃分析来评估疗效,设置更保守的样本量以确保疗效结果的稳定性和可信度,这些措施都可作为其他类似情况下药物研发设计的考量,有一定借鉴意义。第2,加强临床试验中对受试者的安全性监测和记录,一旦观察到任何显著不良反应,应立即采取相应措施,如增加滴定期、调整剂量等,以确保受试者的安全并减少不良反应的发生。第3,通过给受试者提供关怀、传递正向信息、定期随访等措施减少受试者的脱落,提高临床试验的完整性和数据质量。第4,早期试验如已看到较高的明显超过安慰剂组的AE停药率,或许可作为决策研发走向的信号,提示研发者需评估药物的风险效益比,及时终止研发或调整研发策略,避免更大的损失。
参考文献:
[1] 中华医学会妇产科学分会绝经学组. 中国绝经管理与绝经激素治疗指南2023版[J]. 中华妇产科杂志,2023,58(1):4-21.
[2] REES M,ABERNETHY K,BACHMANN G,et al. The essential menopause curriculum for healthcare professionals:A European Menopause and Andropause Society (EMAS) position statement [J/OL]. Maturitas,2022,158:e70-e77. 2022-01-31 [2024-03-10]. https://pubmed.ncbi.nlm.nih.gov/35115178/.
[3] ARMENI E,LAMBRINOUDAKI I,CEAUSU I,et al. Maintaining postreproductive health:A care pathway from the European Menopause and Andropause Society (EMAS) [J/OL]. Maturitas,2016,89:e63-e72. 2016-04-19 [2024-03-10]. https://pubmed.ncbi.nlm.nih.gov/27180162/.
[4] Center for Drug Evaluation and Research. Guidance for Industry:Estrogen and Estrogen/Progestin Drug Products to Treat Vasomotor Symptoms and Vulvar and Vaginal Atrophy Symptoms V Recommendations for Clinical Evaluation [EB/OL]. 2003-01 [2024-03-10]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/estrogen-and-estrogenprogestin-drug-products-treat-vasomotor-symptoms-and-vulvar-and-vaginal-atrophy.
[5] SHANAFELT TD,BARTON DL,ADJEI AA,et al. Pathophysiology and treatment of hot flashes [J]. Mayo Clin Proc,2002,77(11):R1207-R1218.
[6] DEECHER DC,ALFINITO PD,LEVENTHAL L,et al. Alleviation of thermoregulatory dysfunction with the new serotonin and norepinephrine reuptake inhibitor desvenlafaxine succinate in ovariectomized rodent models [J]. Endocrinology,2007,148(3):R1376-R1383.
[7] SPEROFF L,GASS M,CONSTANTINE G,et al. Efficacy and tolerability of desvenlafaxine succinate treatment for menopausal vasomotor symptoms:a randomized controlled trial [J]. Obstet Gynecol,2008,111(1):R77-R87.
[8] ARCHER DF,DUPONT CM,CONSTANTINE GD,et al. Desvenlafaxine for the treatment of vasomotor symptoms associated with menopause:a double-blind,randomized,placebo-controlled trial of efficacy and safety [J]. Am J Obstet Gynecol,2009,200(3):R238.e1-R238.e10.
[9] The Effect Of Dose Titration And Dose Tapering On The Tolerability Of DVS SR In Women With Vasomotor Symptoms [EB/OL]. 2006-11-20 [2024-03-10]. https://classic.clinicaltrials.gov/ct2/show/NCT00401245
[10] ARCHER DF,SEIDMAN L,CONSTANTINE GD,et al. A double-blind,randomly assigned,placebo-controlled study of desvenlafaxine efficacy and safety for the treatment of vasomotor symptoms associated with menopause [J]. Am J Obstet Gynecol,2009,200(2):R172.e1-R172.e10.
[11] BOUCHARD P,PANAY N,DE VILLIERS TJ,et al. Randomized placebo- and active-controlled study of desvenlafaxine for menopausal vasomotor symptoms [J]. Climacteric,2012,15(1):R12-R20.
[12] PINKERTON JV,CONSTANTINE G,HWANG E,et al. Study 3353 Investigators. Desvenlafaxine compared with placebo for treatment of menopausal vasomotor symptoms:a 12-week,multicenter,parallel-group,randomized,double-blind,placebo-controlled efficacy trial [J]. Menopause,2013,20(1):R28-R37.
[13] European Medicines Agency. QUESTIONS AND ANSWERS ON THE WITHDRAWAL OF THE MARKETING APPLICATION for PRISTIQS [EB/OL]. 2008-03-19 [2024-03-10]. https://www.ema.europa.eu/en/documentd/medicine-qa/questions-and-answers-withdrawal-marketing-application-pristiqs_en.pdf.
[14] PEREZ DG,LOPRINZI CL,BARTON DL,et al. Pilot evaluation of mirtazapine for the treatment of hot flashes [J]. J Support Oncol,2004,2(1):R50-R56.
[15] BIRKHAEUSER M,BITZER J,BRAAT S,et al. Esmirtazapine treatment of postmenopausal vasomotor symptoms:two randomized controlled trials [J]. Climacteric,2019,22(3):R312-R322.
[16] STEARNS V,BEEBE KL,IYENGAR M,et al. Paroxetine controlled release in the treatment of menopausal hot flashes:a randomized controlled trial [J]. JAMA,2003,289(21):R2827-R2834.
[17] CRISTINA CASTELLI M,BHASKAR S,LIPPMAN J. Pharmacokinetic properties of once-daily oral low-dose mesylate salt of paroxetine (LDMP 7.5 mg) following single and multiple doses in healthy postmenopausal women [J]. Clin Ther,2013,35(6):R862-R869.
[18] Eight-Week Efficacy & Safety Study of Brisdelle™ (Formerly Known as Mesafem) in the Treatment of Vasomotor Symptoms Associated With Menopause [EB/OL]. 2008-11-06 [2024-03-10]. https://classic.clinicaltrialc.gov/ct2/show/NCT00786188.
[19] SIMON J A,PORTMAN D J,KAUNITZ A M,et al. Low-dose paroxetine 7.5 mg for menopausal vasomotor symptoms:two randomized controlled trials [J]. Menopause,2013,20(10):R1027-R1035.
[20] ORLEANS RJ,LI L,KIM MJ,et al. FDA approval of paroxetine for menopausal hot flushes [J]. N Engl J Med,2014,370(19):R1777-R1779.
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。