泰格洞见
CAR-T细胞免疫疗法,正在强势开启自身免疫病的变革时代
2024年07月11日
嵌合抗原受体T细胞(CAR-T细胞)疗法是一种革命性的癌症治疗方法,利用基因工程改造患者自身的T细胞,使其能够识别并攻击特定的癌细胞。
通过靶向B细胞表面的一种白细胞分化抗原CD19,CAR-T细胞疗法能够有效清除表达CD19的肿瘤细胞,已被批准用于治疗复发和/或难治性B细胞恶性淋巴瘤。证据表明,靶向CD19的CAR-T疗法显示出较高的完全缓解率,许多患者的无进展生存期超过 5 年。
令人翘首以盼的是,CAR-T细胞疗法在癌症治疗中的成功,只是一个开始。近年来,科学家们正在探索如何利用这种强大的工具治疗自身免疫疾病。
自身免疫疾病是指人体的免疫反应错误地攻击个体组织,最终导致器官破坏或功能障碍,包括系统性红斑狼疮(SLE)、类风湿关节炎(RA)、多发性硬化症等。能够产生自身抗体的B细胞在其发病机制中发挥关键作用,因此 B细胞耗竭被视为自身免疫疾病的主要治疗策略[1]。
于是,CAR-T细胞疗法在B细胞恶性淋巴瘤治疗中绽放的光彩,照进了自身免疫疾病治疗领域——既然都能整治住癌变的B细胞,我们可以利用CAR-T去清除那些“内鬼”B细胞。
展开的初步研究结果显示,CAR-T细胞疗法确实能够在系统性红斑狼疮等自身免疫疾病中实现更彻底地耗竭致病性B细胞 。从临床效果看,CAR-T细胞疗法有望用于缓解自身免疫疾病症状,提高患者的生活质量。
今年六月初,美国国立卫生研究院的James N. Kochenderfer在《自然评论免疫学》发表了一篇综述文章[2],对此进行探讨。论文不仅详细介绍了CAR-T细胞疗法的机制和CAR的结构,还讨论了其在多种自身免疫疾病中的应用、疗效及安全性,为进一步研究提供了宝贵的参考。
接下来我们一同探寻,CAR-T细胞疗法究竟如何完成“跨界”,颠覆自身免疫疾病的治疗。

首页截图
明确目标:清除异常B细胞
B细胞最为人熟知的功能是产生抗体。当B细胞产生可识别自身组织成分的抗体时,便会攻击身体的组织和细胞,导致炎症和组织损伤,它们被称为自身反应性B细胞。大多数自身免疫病患者的B细胞免疫耐受性检查点存在缺陷,无法消除自身反应性B细胞,导致疾病发生。此外,B细胞还通过局部产生炎症因子和作为抗原呈递细胞参与疾病发生。
因此,清除异常B细胞成为治疗自身免疫病的治疗策略。
CD19、CD20、CD38和B细胞成熟抗原(BCMA)是B细胞在不同发育和分化阶段表达的表面蛋白,其中CD19 在B细胞全生命周期表达。针对B细胞表面抗原CD20和CD19的靶向药,已经在自身免疫病治疗中显示出显著疗效。例如靶向CD20的利妥昔单抗、靶向CD19的伊奈利珠单抗等,陆续获批用于治疗B细胞驱动的自身免疫病。然而,许多自身免疫疾病对B细胞靶向的单克隆抗体治疗耐药或控制不佳。
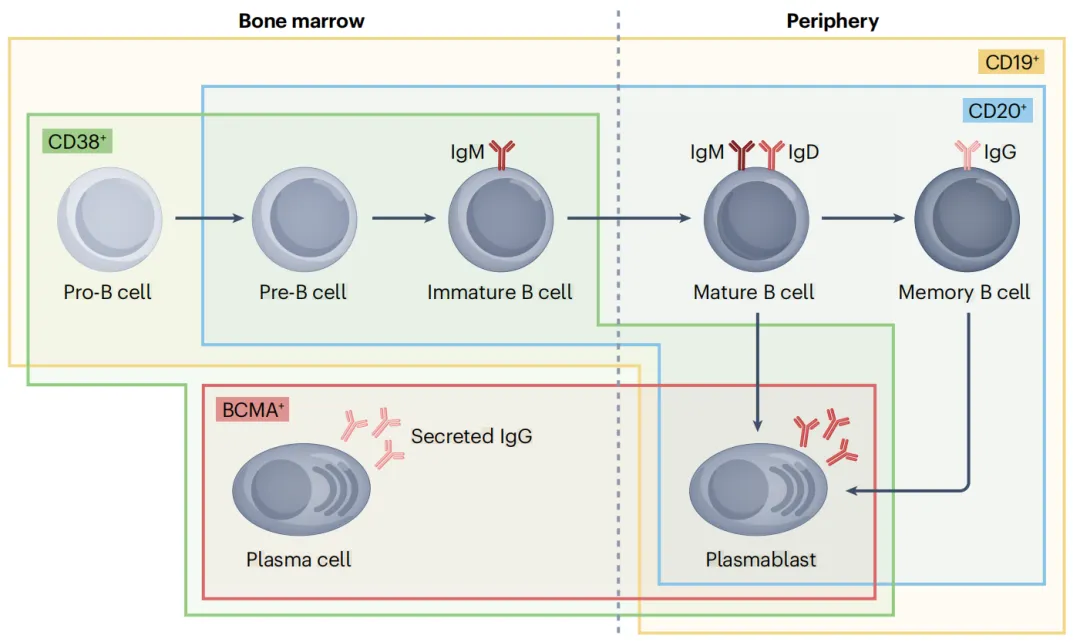
B细胞发育和分化过程中蛋白质标志物的表达
于是,在癌症治疗中展现出卓越B细胞清除能力的CAR-T细胞疗法,被科学家们拿来与自身免疫病进行较量。
CAR-T细胞疗法的原理
在CAR-T疗法中,患者的T细胞被提取并在实验室中进行基因修改,添加一个特殊的受体——嵌合抗原受体(CAR),设计用来识别和结合特定抗原。被CAR“武装”的T细胞经过扩增后重新输注回患者体内,识别并消灭表达目标抗原的细胞。
CAR由五个关键部分组成:
抗原识别域位于细胞外,通常是单链可变片段(scFv),赋予CAR识别抗原的敏感性和特异性。抗原识别域可以靶向肿瘤特异性抗原和自身抗原。自身免疫病中,最常研究的两个靶点抗原是CD19和BCMA。
CAR的细胞内组分包括共刺激域(通常是CD28或4-1BB)和T细胞激活域(通常是CD3ζ链),它们与跨膜域相连,铰链域则负责将抗原识别域和跨膜结构域链接起来。这些结构强烈影响着CAR-T细胞的功能和持久性。

基于单特异性的标准型CAR,为增强疗效和特异性,如今已研发出多种CAR结构策略,包括双顺反子构建体(Bicistronic CAR constructs)、T细胞受体融合构建体(TCR fusion constructs, TRuCs)、装甲策略(Armoured CAR approach)、嵌合自身抗体受体(CAAR)。
其中,双顺反子构建体能够使同一个T细胞同时靶向两个抗原。与仅靶向CD19的CAR相比,同时靶向CD19和BCMA的双顺反子CAR构建体,可能在消除引起自身免疫的抗体方面更胜一筹。另一种CAAR将病原性自体抗原作为抗原识别域,选择性地消除自反应性B细胞。
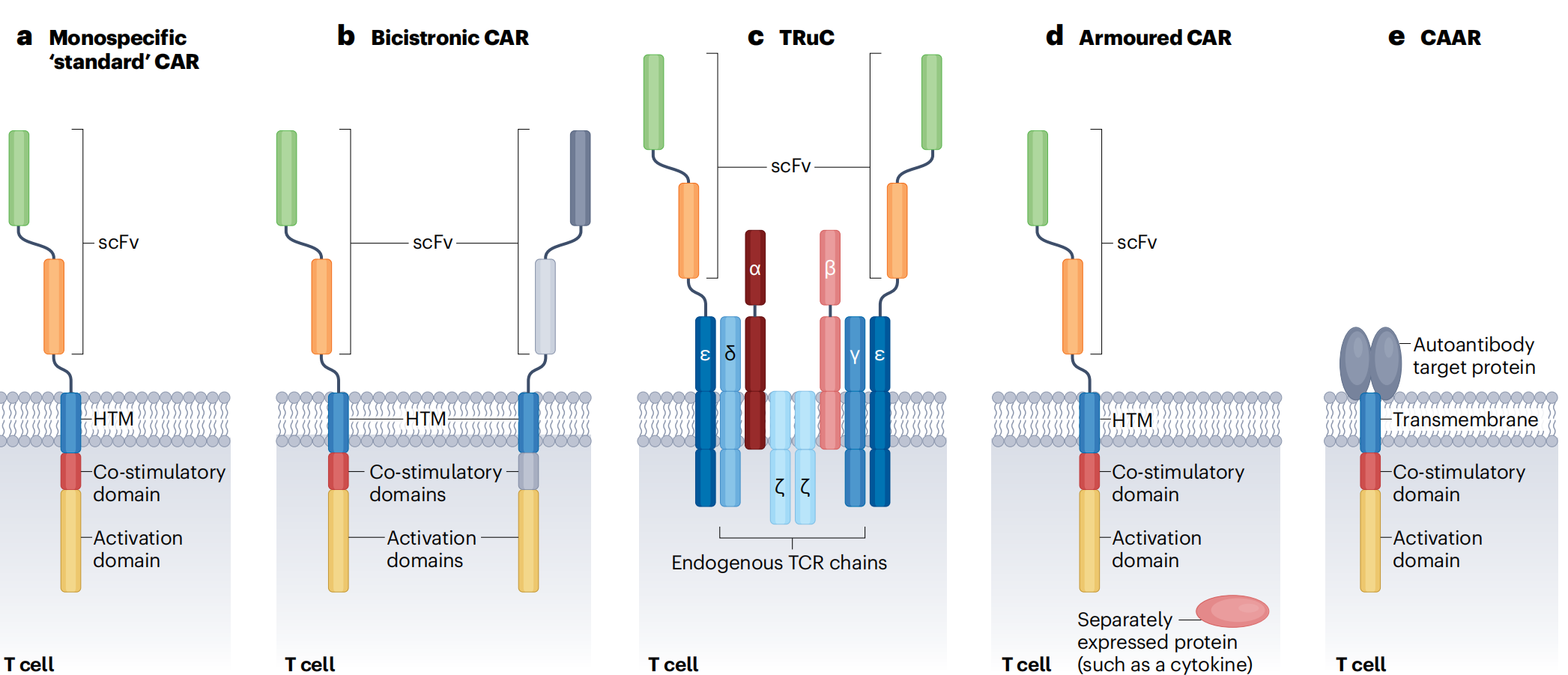
进行转导时,目前大部分自身免疫临床试验使用慢病毒载体将CAR转移到从患者体内提取的T细胞中,该方法的一个缺点是可能发生插入突变。将CAR-T细胞输注到患者体内后,一旦CAR的抗原识别域识别到特定抗原,CAR-T细胞将释放细胞因子、表现细胞毒性并增殖。
自身免疫疾病中构建CAR时,限制细胞因子释放综合症和神经毒性以提高安全标准尤为重要,因为大多数自身免疫病患者比血液恶性肿瘤患者有更长的预期寿命。
初步临床试验已启动,结果激动人心
靶向CD19的CAR-T细胞疗法在急性淋巴细胞白血病和B细胞恶性淋巴瘤中彻底清除B细胞的效果,为其用于自身免疫疾病治疗提供了坚实依据。然而,由于CAR-T细胞是利用患者自身的T细胞制备而成,那么是否会反倒助纣为虐、帮助自身反应性CD4+T细胞进行CAR“武器升级”,导致病情加剧呢?
尽管存在这个风险,不可否认的是,靶向CD19的CAR-T细胞疗法在自身免疫病治疗中显示出了巨大的治疗潜力,并不会加剧病情。
临床前系统性红斑狼疮小鼠模型实验结果表明,自反应性CD4+T细胞可能不会限制CAR-T细胞疗法在自身免疫病中的使用。CAR-T细胞疗法在自身免疫疾病中的应用进入临床研究阶段后,也缓解了这方面的担忧。
初步临床研究提示,靶向CD19的CAR-T细胞疗法在系统性红斑狼疮、抗合成酶抗体综合征、系统性硬化症和重症肌无力等B细胞驱动的难治性自身免疫病中表现出显著疗效,患者病情迅速得到控制、耐受性良好,外周B细胞可以被清除至几乎不可检测的水平,且患者大多此前对其他B细胞靶向治疗失败。这说明CAR-T细胞疗法能够广泛清除多种B细胞亚群,实现前所未见的疾病控制效果。
从安全性来看,细胞因子释放综合征(CRS)和神经毒性综合征(ICANS)是CAR-T细胞疗法的常见副作用。但由于自身免疫病患者没有恶性肿瘤或骨髓浸润,他们发生CRS和ICANS的风险可能比癌症患者更低。与之猜想相符,早期临床试验结果显示,接受靶向CD19的CAR-T细胞疗法的自身免疫疾病患者大多只出现低级别的CRS,并且未见严重的神经毒性,这些副作用较轻且可控。
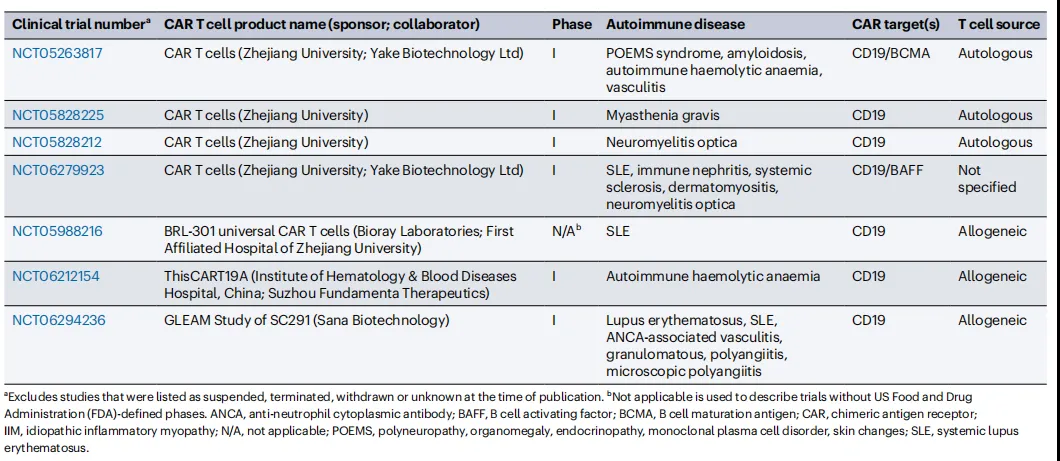
靶向CD19的CAR-T细胞疗法用于治疗自身免疫病时,还存在一个担忧,即自身抗体可能由CD19阴性的长寿命浆细胞(LLPCs)产生。不过,在5名重症系统性红斑狼疮患者的治疗过程中,靶向CD19的CAR-T细胞疗法能够显著降低抗双链DNA抗体水平,表明CD19阳性细胞是主要的自身抗体来源。
当然,也有应对长寿命浆细胞的策略,如针对CD38的靶向药达雷妥尤单抗以及蛋白酶体抑制剂硼替佐米,这些方法在多发性骨髓瘤和自身免疫疾病中均具有显著疗效,并能够减少长寿命浆细胞产生的自身抗体。此外,在设计CAR-T时,将BCMA作为单一靶点或者联合CD19作为双特异性靶点,在重症肌无力和系统性红斑狼疮中显示出潜在的临床获益。
为了避免误伤非致病性B细胞,科学家们在设计CAR结构时,会采用以致病性自身抗原作为抗原识别域的CAAR,安装到T细胞后,使T细胞能够特异性识别并消除自身反应性B细胞。CAAR-T细胞疗法用于天疱疮、重症肌无力等相关临床试验已经展开。
因势利导,动员特殊T细胞
将CAR-T细胞疗法用于治疗自身免疫病时,T细胞的选择可以灵活转变。
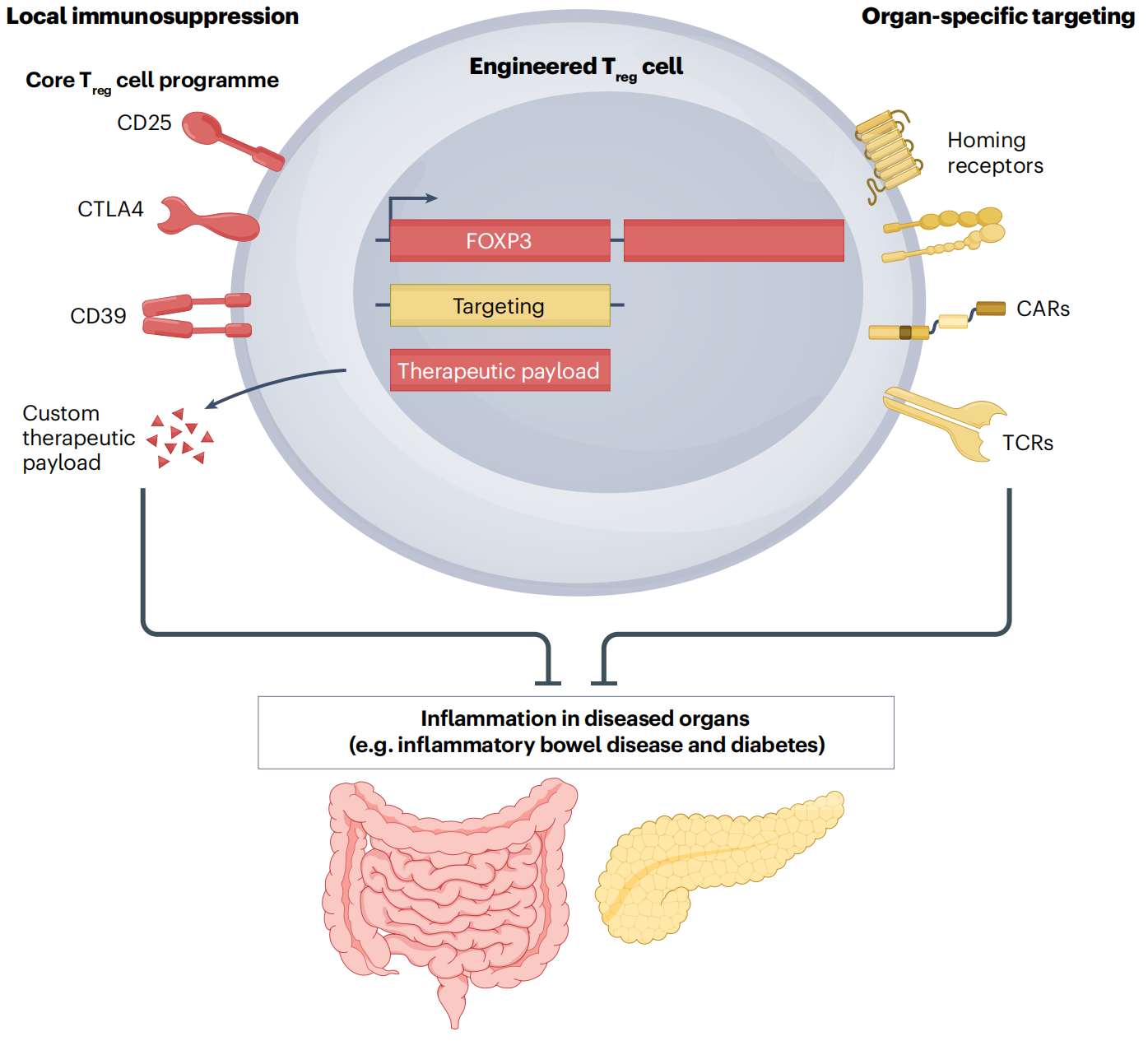
调节性T细胞(Treg)通过多种机制,在维持免疫耐受和抑制自身免疫反应中起重要作用。天然存在的Treg细胞,或是工程化改造表达FOXP3的CD4+T细胞,可以进一步经过转导表达特定的归巢受体(如趋化因子受体或整合素)、CAR结构或T细胞抗原受体(TCR),使Treg细胞能针对特定疾病相关抗原进行靶向,如肠道的粘膜血管细胞粘附分子或骨髓的特定趋化因子,从而定位至患病组织,在不影响整体免疫系统的情况下发挥局部免疫抑制作用。
也就是说,“武装”上CAR结构的Treg细胞,在自身免疫病治疗中能够定向到炎症部位提供免疫调节作用,提高疗效的同时减少广泛的免疫抑制。这样一来,靶向CD19的CAR-Treg细胞可以在不完全消除B细胞的情况下控制自身抗体的产生,恢复免疫系统的平衡。
CAR-Treg细胞疗法需要考虑的关键之处,在于确保其表型的稳定性。稳定的Treg细胞不会产生促炎性细胞因子,因此与CAR-T细胞疗法相比,CAR-Treg细胞疗法的CRS风险较低。
为此,在设计CAR结构时,胞内的共刺激域可以选择CD28。CD28在Treg细胞的发育中起关键作用,而含有4-1BB的CAR-Treg细胞倾向于自发增殖,可能导致细胞耗竭。这意味着,选择共刺激域时,CD28在维持Treg细胞功能和稳定性方面可能比4-1BB更为重要。
CAR-Treg细胞疗法的进一步工程化策略,还包括引入如IL-10或双调蛋白等免疫调节因子的基因,以增强其免疫调节功能。
目前Treg细胞在1型糖尿病中的作用已被广泛研究,CAR-Treg细胞疗法可以有效延迟或防止小鼠1型糖尿病的发生。也有临床研究开始对CAR-Treg细胞在预防器官移植排斥反应中的作用进行评估,并探索CAR-Treg细胞疗法在炎症性肠病和多发性硬化等其他疾病中的治疗潜力。
CAR-T治疗前的准备
为了增强治疗效果,在癌症治疗中,进行CAR-T细胞治疗前的化疗通常是必要的。
对于自身免疫病患者而言,最佳的预处理方案尚未确定。但是,在靶向CD19的CAR-T细胞治疗中,环磷酰胺和氟达拉滨的组合显示出良好的效果和急性期内的耐受性。
值得注意的是,环磷酰胺可能诱发继发性肿瘤并影响生育能力,这对年轻女性患者而言尤为关键;氟达拉滨则极少数情况下会引起视力丧失。在这种情况下,鉴于治疗自身免疫病与肿瘤发生的风险获益比相矛盾,亟需开发更安全的CAR-T细胞治疗前方案。
另一方面,由于免疫抑制药物可能会干扰CAR-T细胞的制备和功能,可能需要自身免疫病患者在采集和输注CAR-T细胞前减少或停用这些药物,无法完全停药时可以使用低剂量类固醇。未来将进一步探索,在CAR-T细胞治疗自身免疫病的过程中,如何指导免疫抑制剂的使用。
CAR-T细胞的影响持久
CAR-T细胞疗法通过全面清除致病性B细胞,可能导致免疫系统“重置”,从而在自体免疫疾病治疗中产生长期疗效。
目前证据表明,尽管B细胞在治疗后较早恢复,但疾病改善仍可维持。在系统性红斑狼疮患者的临床试验中,患者治疗后平均在110±32天后B细胞恢复,但随访12个月未见疾病复发。这与癌症患者B细胞恢复时间较长(中位时长12个月)的现象形成对比,可能是由于自体免疫疾病患者治疗前接受的淋巴耗竭化疗较少。
此外,在自身免疫病中,随着炎症的控制,Treg细胞的数量和功能可能会受损。不过有证据表明,CAR-Treg细胞即使被清除后,对自身抗原或异体抗原降低的免疫反应仍可持续存在。
综上所述,CAR-T细胞疗法相比单克隆抗体能更彻底消耗B细胞,CAR-Treg细胞疗法则可以维持炎症部位的外周耐受性。这些细胞靶向治疗有望实现各种自身免疫病的持久缓解,这将是传统疗法的重大进步。同时,CAR-T细胞疗法还可能具有更良好的安全性,这是先前自身免疫细胞疗法(例如造血干细胞移植)所无法比拟的。
CAR-T细胞疗法在自身免疫疾病治疗中展现出巨大潜力,其长期疗效与安全性仍需进一步研究确认。随着更多临床试验的进行,这些创新治疗将为自身免疫病患者开辟新的治疗希望,并推动整个免疫治疗领域的进步。
遇上自身免疫疾病,CAR-T细胞疗法能否再度创造奇迹,我们拭目以待!
参考文献:
[1]Lee DSW, Rojas OL, Gommerman JL. B cell depletion therapies in autoimmune disease: advances and mechanistic insights. Nat Rev Drug Discov. 2021 Mar;20(3):179-199. doi: 10.1038/s41573-020-00092-2. Epub 2020 Dec 15. PMID: 33324003; PMCID: PMC7737718.
[2]Chung, J.B., Brudno, J.N., Borie, D. et al. Chimeric antigen receptor T cell therapy for autoimmune disease. Nat Rev Immunol (2024). https://doi.org/10.1038/s41577-024-01035-3
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。